现有常温时pH=1的某强酸溶液10mL,下列操作能使溶液的pH变成2的是
( )
| A.加入10mL 的水进行稀释 |
| B.加水稀释成100mL |
| C.加入45mL 0.01mol/L的NaOH溶液 |
| D.加入10mL 0.01mol/L的盐酸溶液 |
已知2SO2+O2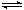 2SO3;△H=-92.6 kJ·mol-1,当反应达到平衡时,下列措施:①降低温度;②减小压强;③用V2O5作催化剂;④增大O2的浓度;⑤增大SO2的浓度;⑥恒压通入He气,能提高SO2转化率的是
2SO3;△H=-92.6 kJ·mol-1,当反应达到平衡时,下列措施:①降低温度;②减小压强;③用V2O5作催化剂;④增大O2的浓度;⑤增大SO2的浓度;⑥恒压通入He气,能提高SO2转化率的是
| A.①②⑥ | B.①④⑤ | C.④⑤⑥ | D.①④ |
下列分析推断有错误的是
| A.“冰,水为之,而寒于水”说明相同质量的水和冰,冰的能量较低 |
| B.某温度下,向饱和食盐水中通入HCl气体没有明显的现象发生 |
| C.相同温度下,把水面上的空气换成相同压力下的纯氧,100g水中溶入氧气的质量增加 |
| D.将外形不规则的胆矾晶体投入饱和硫酸铜溶液中,通过观察晶体外形的变化而晶体质量保持不变,能证明溶解平衡是一个动态平衡 |
下列说法正确的是
| A.煤炭燃烧时加少量的水,可以使煤炭燃烧放出更多的热量 |
| B.反应2Na2O2+2H2O = 4Na++4OH-+O2在任何条件下均能自发 |
| C.已知P4(白磷,s)="4" P(红磷,s); △H =-29.2kJ·mol-1,则白磷比红磷稳定 |
| D.已知H2的标准燃烧热为285.8 kJ·mol-1,则H2燃烧的热化学方程式表示为: |
2H2(g)+O2(g)=2H2O(g);ΔH=-571.6 kJ·mol-1
在一定条件下,硫酸铵的分解反应为:(NH4)2SO4→N2↑+NH3↑+SO2↑+SO3+H2O(未配平),下列说法正确的是
| A.反应中,硫元素部分被氧化,氮元素部分被还原 |
| B.反应中每产生1molN2必同时产生2molSO2 |
| C.反应中每转移1mol电子就会生成0.5molSO2 |
| D.当(NH4)2SO4的计量数为4时,产生NH3和SO2的物质的量之比为1:3 |
某密闭绝热容器中盛有饱和Ca(OH)2溶液,加入少量CaO粉末,下列说法正确的是
①一定有固体析出 ②溶质的质量一定增加 ③溶剂的质量一定减少 ④pH一定减小
| A.①②③④ | B.①②③ | C.①③④ | D.②④ |