碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s)
下列说法错误的是
| A.电池工作时,锌失去电子 |
| B.电池工作时,电子由正极通过外电路流向负极 |
| C.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e—=Mn2O3(s)+2OH—(aq) |
| D.外电路中每通过O.2mol e-,锌的质量理论上减小6.5g |
下列各组物质中属于同分异构体的是
| A.H2O和D2O |
| B.O2和O3 |
| C.CH3CH2OH和CH3-O-CH3 |
D.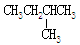 和 和 |
下列实验不能获得成功的是
| 实验目的 |
实验步骤 |
|
| A. |
探究催化剂对化学反应速率的影响 |
向H2O2溶液中滴加少量FeCl3溶液 |
| B. |
探究乙醇能发生氧化反应 |
将铜丝在酒精灯加热后,立即伸入无水乙醇中 |
| C. |
探究石蜡油分解的产物不都是烷烃 |
将石蜡油加强热产生的气体通入溴的四氯化碳溶液中 |
| D. |
除去甲烷中混有的乙烯 |
把混合气体通入酸性高锰酸钾溶液 |
向一恒容密闭容器中充入2 mol SO2和1mol O2,在一定条件下发生反应:2SO2+O2 2SO3,下列有关说法正确的是
2SO3,下列有关说法正确的是
| A.达到化学平衡时,正反应和逆反应的速率都为零 |
| B.当O2的浓度不变时,反应达到平衡状态 |
| C.当单位时间消耗a mol O2,同时消耗2a mol SO2时,反应达到平衡状态 |
| D.当SO2、O2、SO3的分子数比为2:1:2,反应达到平衡状态 |
下列关于苯的叙述正确的是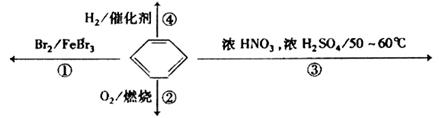
| A.反应①为取代反应,有机产物的密度比水小 |
| B.反应②为氧化反应,反应现象是火焰明亮并带有较多的黑烟 |
| C.反应③为取代反应,有机产物是一种烃 |
| D.反应④中1mol苯最多与3 mol H2发生加成反应,是因为苯分子含有三个碳碳双键 |
把甲、乙、丙、丁四块金属泡在稀H2SO4中,用导线两两相连可以组成各种原电池。若甲、乙相连,甲为负极;丙、丁相连,丁上有气泡逸出;甲、丙相连,甲上发生氧化反应;乙、丁相连,乙是电子流入的一极。则四种金属的活泼性顺序由大到小排列为
| A.甲>乙>丙>丁 | B.甲>丙>乙>丁 | C.甲>丙>丁>乙 | D.乙>丁>丙>甲 |