如图所示,将镁片、铝片平行插入一定浓度的NaOH溶液中,用导线连接成闭合回路,该装置在工作时,下列叙述中正确的是 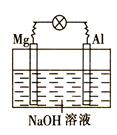
| A.镁比铝活泼,镁失去电子被氧化成Mg2+。 |
| B.铝是电池的负极,开始工作时溶液中会立即有白色沉淀生成 |
| C.该装置的内、外电路中,均是电子的定向移动形成电流 |
| D.该装置开始工作时,铝片表面的氧化膜可不必处理 |
在一个固定容积的密闭容器中,发生如下反应:2A(g)+B(g)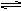 3C(g)+D(g),当加入4molA和2molB,达到化学平衡时,C的物质的量浓度为W mol/L。若维持温度不变,按下列四种配比为起始物质,达到化学平衡后,C仍为W mol/L的是
3C(g)+D(g),当加入4molA和2molB,达到化学平衡时,C的物质的量浓度为W mol/L。若维持温度不变,按下列四种配比为起始物质,达到化学平衡后,C仍为W mol/L的是
| A.2molA+1molB | B.6molC+2molD |
| C.3molC+1molD | D.4molA+2molB+3molC |
可以证明可逆反应N2 + 3H2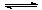 2NH3已达到平衡状态的是:①一个N-N断裂的同时,
2NH3已达到平衡状态的是:①一个N-N断裂的同时,
有3个H-H键断裂;②一个N-N键断裂的同时,有6个N-H键断裂;③其它条件不变
时,混合气体平均式量不再改变;④保持其它条件不变时,体系压强不再改变;⑤NH3%、
N2%、H2%都不再改变;⑥恒温恒容时,密度保持不变;⑦正反应速率v(H2)=0.6mol/(L·min)
逆反应速率v(NH3)=0.4mol/(L·min)。()
| A.全部 | B.只有①③④⑤ | C.②③④⑤⑦ | D.只有①③⑤⑥⑦ |
恒温下,下列物质的状态变化中,△S变化最大的是()
| A.H2O(l)=H2O(g) | B.H2O(s)=H2O(g) |
| C.H2O(s)=H2O(l) | D.H2O(l)=H2O(s) |
在一固定容积的密闭容器中充入2 mol A 和1 mol B ,发生反应:2A(g)+ B(g) xC(g),达到平衡后,C的体积分数为W% 。若维持容器体积和温度不变,按0.6 mol A、0.3 mol B、1.4 mol C 为起始物质,达到平衡后,C的体积分数也为W% ,则x值为()
xC(g),达到平衡后,C的体积分数为W% 。若维持容器体积和温度不变,按0.6 mol A、0.3 mol B、1.4 mol C 为起始物质,达到平衡后,C的体积分数也为W% ,则x值为()
A.只能为2 B.只能为3 C.可能是2,也可能是3 D.无法确定
一定条件下,在密闭容器中,能表示反应X(g)+2Y(g) 2Z(g)一定达到化学平衡状态的是()
2Z(g)一定达到化学平衡状态的是()
①X、Y、Z的物质的量之比为1∶2∶2
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成n mol Z,同时生成2n mol Y
| A.①② | B.①④ | C.②③ | D.③④ |