在一定温度下的定容容器中,当下列物理量不再发生变化时,不能表明可逆反应A(g) + 2B(g) C(g) + D(g)(正反应为放热反应)已达到平衡状态的是
C(g) + D(g)(正反应为放热反应)已达到平衡状态的是
| A.混合气体的压强 |
| B.混合气体的密度 |
| C.B的物质的量浓度 |
| D.反应放出的热量 |
25°C时某些弱酸的电离平衡常数Ka如下表,下列说法正确的是
| A.相同pH的三种酸溶液,物质的量浓度由大到小的顺序为:c(HClO)>c(CH3COOH)>c(H2CO3) |
| B.在相同物质的量浓度的Na2CO3、NaClO、NaHCO3与CH3COONa四种钠盐中加水稀释,水解程度均增大,碱性均增强 |
| C.等物质的量浓度的NaClO和NaHCO3混合溶液中:c(Na+)=c(HClO)+c(ClO-)+c(HCO3-)+c(CO32-)+c(H2CO3) |
| D.向次氯酸钠溶液中通入少量二氧化碳气体的离子方程式为:2ClO-+CO2+H2O=CO32-+2HClO |
下列各组离子在溶液中能够大量共存的是
| A.Na+、Al3+、Cl-、HCO3- |
| B.使pH试纸显蓝色的溶液:K+、Cu2+、Cl-、SO42- |
| C.滴入甲基橙指示剂呈红色的溶液:Na+、NH4+、ClO4-、NO3- |
| D.水电离出的c(H+)=1×10-13mol/L的溶液:K+、NH4+、SO32-、Cl- |
一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是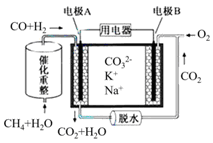
A.反应CH4+H2O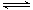 3H2+CO,每消耗1molCH4转移12mol电子 3H2+CO,每消耗1molCH4转移12mol电子 |
| B.电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O |
| C.电池工作时,CO32-向电极B移动 |
| D.电极B上发生的电极反应为:O2+2CO2+4e-=2CO32- |
一定温度下,在2.5L的恒容密闭容器中发生如下反应:CO2(g)+H2S(g) COS(g)+H2O(g)
COS(g)+H2O(g)
| 实验 |
温度/K |
起始物质的量/mol |
平衡物质的量/mol |
平衡常数 |
|
| CO2 |
H2S |
H2O |
|||
| I |
607 |
0.11 |
0.41 |
0.01 |
|
| II |
607 |
0.22 |
0.82 |
||
| III |
620 |
0.1 |
0.4 |
6.74×10-3 |
下列说法不正确的是
A.该反应正反应为吸热反应
B.607K时,把物质的量均为0.1mol四种反应物加入该反应器中,反应将向正反应方向进行
C.实验Ⅱ达到平衡时容器中COS的物质的量为0.02mol
D.实验Ⅲ中,无论是开始还是至化学平衡状态,混合气体的密度始终不变
常温下pH=3的二元弱酸H2R溶液与a L pH=11的NaOH溶液混合后,混合液的pH刚好等于7(假设反应前后体积不变),则对反应后混合液的叙述正确的是
| A.c(R2-)+c(OH-)=c(Na+)+c(H+) |
| B.c(R2-)>c(Na+)>c(H+)=c(OH-) |
| C.2c(R2-)+c(HR-)=c(Na+) |
| D.混合后溶液的体积为2a L |