浓盐酸和氯酸钾的反应如下:KClO3 + 6HCl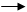 KCl + 3Cl2 ↑ + 3H2O其中发生氧化反应的氯原子和发生还原反应的氯原子的质量比是
KCl + 3Cl2 ↑ + 3H2O其中发生氧化反应的氯原子和发生还原反应的氯原子的质量比是
| A.1∶6 | B.1∶5 | C.5∶1 | D.6∶1 |
煤是“工业的粮食”,石油是“工业的血液”。有关煤和石油加工的说法正确的是
| A.煤的干馏产物主要是各类有机物 |
| B.石油的裂解、分馏和煤的干馏都属于化学变化 |
| C.煤焦油经过分馏可得到苯、甲苯等,说明煤中含有苯和甲苯 |
| D.石油的裂化,说明长链烃在高温条件下可以分解为短链烃 |
简缩记忆法是学好化学的有效方法之一。下列有关实验,记忆简缩正确的是
①粉末状或细粒状固体的取用:一斜、二送、三直立
②块状固体或密度较大的大颗粒状固体的取用:一横、二放、三慢竖
③过滤的操作要点:一贴、二低、三靠
④气体的鉴别通常的步骤是:一看颜色、二闻气味、三用“火”试、四用试剂
| A.①②③④ | B.①②③ | C.①③④ | D.②③④ |
元素之间通过不同的化学键可以组成不同的晶体和化合物。有关化学键与晶体的说法正确的是
| A.两种元素组成的分子中一定只有极性键 |
| B.熔融状态时能导电的化合物一定是离子晶体 |
| C.非金属元素组成的化合物一定是共价化合物 |
| D.分子晶体的熔沸点随着共价键的增强而升高 |
我国科学家通过测量SiO2中26Al和10Be两种元素的比例来确定“北京人”年龄,这种测量方法叫铝铍测年法。关于26Al和10Be的说法不正确的是
| A.10Be和9Be是中子数不同质子数相同的不同原子 |
| B.10Be的原子核内中子数比质子数多 |
| C.5.2 g26Al3+中所含的电子数约为1.2×1024 |
| D.26Al和26Mg的质子数、中子数和核外电子数都不相同 |
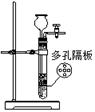
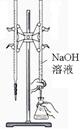
完成下列实验,所选装置正确的是()
| A |
B |
C |
D |
|
| 实验 目的 |
检查装置气密性 |
实验室用纯碱和稀硫酸制备二氧化碳 |
用已知浓度的氢氧化钠溶液测定未知浓度盐酸 |
从碘的CCl4溶液中分离出碘 |
| 实验装置 |
 |
 |
 |
 |