在金属卤化物中,能用于人工降雨的物质是 ,用于制作照相感光底片的物质是 。漂白粉的成份是 ,有效成分是 ,搅拌溶于水后,发生反应的化学方程式为 。
高炉炼铁中发生的基本反应之一如下:
FeO(s)+ CO (g)  Fe(s)+ CO2(g)△H>0
Fe(s)+ CO2(g)△H>0
(1)此反应的平衡常数表达式为:K=
(2)温度升高,达到新的平衡后,高炉内CO2与CO的体积比(填“增大”、 “减小”或“不变”)。
(3)已知1100℃时,K= 0.263。某时刻测得高炉中c(CO2)=" 0.025" mol·L-1,c(CO)=" 0.1" mol·L-1,在这种情况下,该反应(填“是”或“不是”)处于化学平衡状态。
如果“不是”,此时化学反应向方向进行(填“正反应”或“逆反应”)。如果“是”,此空不填
日常生活中,可用明矾[KAl(SO4)2·12H2O]作为净水剂,这是因为:明矾溶于水发生水解反应,生成氢氧化铝胶体,氢氧化铝胶体可以吸附杂质。写出水解反应的离子方程式为:
pH = 2与pH = 5的两强酸溶液各10 mL,混合后溶液的pH为。
纯水在20 ℃的pH(填“大于”或“小于”)80 ℃时的pH。
可逆反应: 根据图回答:
根据图回答: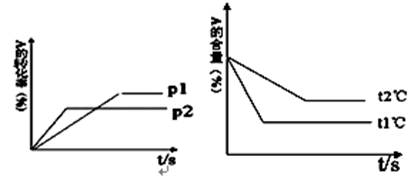
(1)压强 P1比P2(填“大”或“小”);
(2)(a +b)比(c +d)(填“大”或“小”);
(3)温度t1℃比t2℃(填“高”或“低”);
(4)正反应为反应(填“吸热”或“放热”);