两位同学设计了下述两个方案, 并都认为如果观察到的现象和自己所设计的方案一致,即可确定无色气体中一定含有SO2和CO2气体。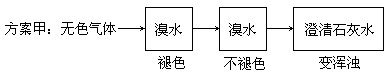
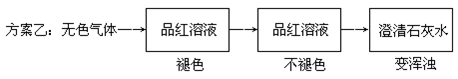
请你评价上述两个方案是否严密,并说明理由。
方案甲:_________,______________________
方案乙:_________,_______________________ 。
某研究性学习小组在CO还原Fe2O3的实验中,用磁铁吸出生成的黑色粉末X,他们认为X不一定是Fe,若温度不均时会生成Fe3O4,也能被磁铁吸引。为了探究X的组成,他们进行了如下实验。
I、定性检验
| 实验编号 |
实验操作 |
实验现象 |
| ① |
取少量黑色粉末X放入试管1中,注入浓盐酸,微热 |
黑色粉末逐渐溶解,溶液呈黄绿色,有少量气泡产生 |
| ② |
另取少量黑色粉末X放入试管2中,注入足量硫酸铜溶液,振荡,静置 |
有极少量红色物质析出,仍有较多黑色固体未溶解 |
由上述实验现象推断,黑色粉末X的成分是。
II定量测定
⑴操作Z的名称是。
下列仪器中,在灼烧沉淀时必须用到的是(填字母)。



A B C D E F
⑵写出溶液Y中滴加H2O2溶液时发生反应的离子方程式。
⑶将沉淀物加热,并置于干燥器中冷却至室温,用托盘天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2g,若b1—b2 = 0.3g,则接下来还应进行的操作是 。
。
⑷有同学认为:上述流程若不加入H2O2,其它步骤不变,只要在空气中充分放置仍可达到目的。他的理由是。(用化学方程式表示)
⑸通过以上数据,得出2.376g黑色粉末中各成分的物质的量为。
某地市场销售的某种食用精制盐包装袋上有如下说明:
| 产品标准 |
GB5461 |
| 产品等级 |
一级 |
| 配料 |
食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) |
20~50mg/kg |
| 分装时期 |
|
| 分装企业 |
⑴碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处)
KIO3+KI+H2SO4=K2SO4+I2+H2O
⑵上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及在上述步骤中的位置是。
⑶已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a. 准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是。
②b中反应所产生的I2的物质的量是mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)_________________________mg/kg。
实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫,有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫。
(1)写出实验室制乙烯的反应方程式:
(2)Ⅰ、Ⅱ、Ⅲ、Ⅳ装置可盛放的试剂是:Ⅰ___________;Ⅱ___________;Ⅲ___________;Ⅳ:浓溴水(将下列有关试剂的序号填入空格内)。
| A.品红溶液 | B.NaOH溶液 | C.浓H2SO4 | D.酸性KMnO4溶液 |
(3)能说明二氧化硫气体存在的现象是_______________________________。
(4)确证含有乙烯的现象是_________________________________________。
(5)写出Ⅳ中发生反应的化学方程式:。
实验室用下图装置制取少量溴苯,试填写下列空白。
(1).写出仪器A的名称;B的名称;
(2).请你写出实验室制取溴苯的化学方程式 ___ ;
(3).长导管的下口为什么不插入锥形瓶的液面下
(4).反应完毕后,向烧瓶A中滴加NaOH 溶液的作用是:
(5).冷凝水的进水口是(填m或n),,图中干燥管C的作用是
海洋植物如海带.海藻中含有丰富的碘元素,其主要以碘化物形式存在。有一化学课外小组用海带为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间(以让碘化物充分溶解在水中),得到海带灰悬浊液,然后按以下实验流程提取单质碘:(已知: 2I- + Cl2=2Cl-+ I2)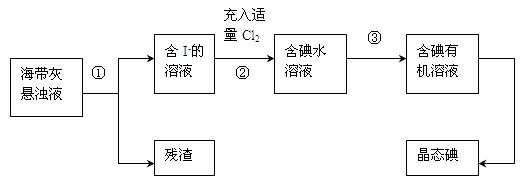
(1)指出提取碘的过程中有关的实验操作名称:①,③;
(2)过程②中充入适量Cl2的目的是;
(3)操作③中所用的有机试剂可以是(只填一种),
(4)操作过程③可以分解为如下几步:
| A.把盛有溶液的分液漏斗放在铁架台的铁圈中; |
| B.把50ml碘水和15ml有机溶剂(你所选的)加入分液漏斗中,并盖好玻璃塞; |
| C.检验分液漏斗活塞和上口的玻璃塞是否漏液; |
| D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正; |
E.旋开活塞,用烧杯接收溶液;
F.从分液漏斗上口倒出上层液体;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
H.静置、分层。
(a)过程③正确操作步骤的顺序是:(填编号字母);
(b)上述G步操作的目的是:;