下列反应的离子方程式正确的是
| A.小苏打与氢氧化钠溶液的反应:OH-+ H+ = H2O |
| B.实验室制二氧化碳:CaCO3 + 2H+ = CO2↑ + H2O + Ca2+ |
| C.氯气与水反应:Cl2 + H2O = Cl-+ ClO-+ 2H+ |
| D.AlCl3溶液与过量氨水反应:Al3+ + 4NH3·H2O = AlO2-+ 4NH4+ + 2H2O |
在宏观、微观和符号之间建立联系是化学学科的特点。
(1)将一块冰糖放入水中,糖块逐渐变小,其微观解释是 。
(2)干冰和二氧化碳化学性质相同的微观解释是 ,二者物理性质不同的微观原因是 。
(3)下列物质中既存在离子又存在分子的是
| A.氯化钠晶体 | B.金刚石 | C.氯化钠溶液 | D.液氧 |
(4)某密闭容器中物质变化过程的微观示意图如下,请回答:
变化Ⅰ表示的宏观事实是 (用方程式表示);
变化Ⅱ表示的宏观事实是 。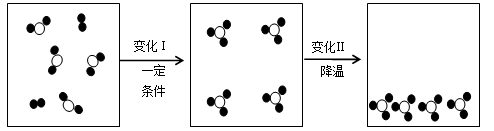
(已知: 代表氧原子,
代表氧原子,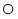 代表硫原子)
代表硫原子)
目前市面上有一种新型饭盒“即热饭盒”,其原理是在饭盒底部有两层,一层存放水,另一层存放镁和铁的混合物。使用时打开隔离层,即发生以下反应: Mg + 2H2O ="=" X + H2↑。根据上述信息回答下列问题:
(1)该饭盒底部“即热”的原理是将化学能转化为 能;
(2)已知X是一种碱,请写出X的化学式 。
用化学符号填空:
(1)①盐酸、硫酸都能使紫色石蕊溶液变红的原因是溶液中都存在 ;
②高锰酸钾中锰元素的化合价 。
(2)①盐酸除铁锈的反应方程式 ;
②只选用一种溶液和金属丝、通过一次反应就能将铁、铜、银的活动性验证出来,发生反应的方程式是 。
除去下列物质中混有的杂质,所选用的试剂及操作方法均正确的是
| 物质 |
杂质 |
除杂质应选用的试剂和操作方法 |
|
| A |
CO2 |
CO |
通入O2,点燃 |
| B |
NaOH固体 |
Na2CO3固体 |
加入过量盐酸,蒸发 |
| C |
Cu(NO3)2溶液 |
AgNO3溶液 |
加入过量的铜粉,过滤 |
| D |
KNO3溶液 |
KOH溶液 |
加入适量的CuSO4溶液,过滤 |
把一定质量的a、b、c、d四种物质放入一密闭容器中,在一定条件下反应一段时间后,则得反应后各物质的质量如下。下列说法中正确的是
| 物质 |
a |
b |
c |
d |
| 反应前的质量(g) |
6.4 |
3.2 |
4.0 |
2.8 |
| 反应后的质量(g) |
5.2 |
X |
7.2 |
2.8 |
A.a和c是反应物B.d一定是催化剂
C.X=2.0g D.该反应是化合反应