关于某一化学反应的熵变,下列说法正确的是( )
| A.△S为反应产物总熵与反应物总熵之差 |
| B.△S与S一样随温度变化不大 |
| C.凡是熵增加的反应一定能自发进行 |
| D.在温度、压强一定的条件下,焓变和熵变共同决定化学反应进行的方向 |
下面四个选项是四位同学在学习过化学反应速率和化学平衡理论以后,联系化工生产实际所发表的看法,其中,你认为不正确的是
| A.化学反应速率理论可指导怎样在一定时间内快出产品 |
| B.化学平衡理论可指导怎样使用有限原料多出产品 |
| C.化学反应速率理论可指导怎样提高原料的转化率 |
| D.正确利用化学反应速率和化学平衡理论都可提高化工生产的综合经济效益 |
某反应2AB(g)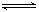 C(g)+3D(g)在高温时能自发进行,其逆反应在低温下能自发进行,则该反应的ΔH、ΔS应为
C(g)+3D(g)在高温时能自发进行,其逆反应在低温下能自发进行,则该反应的ΔH、ΔS应为
| A.ΔH<0,ΔS>0 | B.ΔH <0,ΔS<0 |
| C.ΔH>0,ΔS>0 | D.ΔH>0,ΔS<0 |
某温度下,反应N2O4(g) 2NO2(g)△H>0,在密闭容器中达到平衡。下列说法不正确的是()
2NO2(g)△H>0,在密闭容器中达到平衡。下列说法不正确的是()
| A.加压时(体积变小),将使正反应速率增大 |
| B.保持体积不变,升高温度,再达平衡时颜色变深 |
| C.保持体积不变,加入少许N2O4,再达到平衡时,颜色变深 |
| D.保持体积不变,加入少许NO2,将使正反应速率减小 |
已知:(NH4)2CO3(s)=NH4HCO3(s)+NH3(g)△H=+74.9kJ·mol—1,下列说法中正确的是
| A.该反应中熵变、焓变皆大于0 |
| B.该反应是吸热反应,因此一定不能自发进行 |
| C.碳酸盐分解反应中熵增加,因此任何条件下所有碳酸盐分解一定自发进行 |
| D.能自发进行的反应一定是放热反应,不能自发进行的反应一定是吸热反应 |
工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g)====Si(s)+4HCl(g) ΔH=" +Q" kJ·mol-1 (Q>0)
某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是()
| A.反应过程中,若增大压强能提高SiCl4的转化率 |
| B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ |
| C.反应至4 min时,若HCl浓度为0.12 mol·L-1,则H2的反应速率为0.03 mol/(L·min) |
| D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol·L-1的NaOH溶液恰好反应 |