反应C(s)+H2O(g)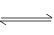 CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
| A.增加水蒸汽的量 | B.将容器的体积缩小一半 |
| C.保持体积不变,充入N2使体系压强增大 | D.保持压强不变,充入N2使容器容积变大 |
下面四种变化中,有一种变化与其他三种变化类型不同的是:
A.CH3CH2OH + CH3COOH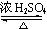 CH3COOCH2CH3 + H2O CH3COOCH2CH3 + H2O |
B.CH3CH2OH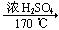 CH2=CH2↑+H2O CH2=CH2↑+H2O |
C.2CH3CH2OH CH3CH2OCH2CH3 + H2O CH3CH2OCH2CH3 + H2O |
D. + HNO3 + HNO3  -NO2+H2O -NO2+H2O |
对下列有关实验的描述正确的是
| A.配制银氨溶液时,将硝酸银溶液逐滴滴入氨水中 |
| B.苯中混有苯甲酸,加足量NaOH溶液,然后分液 |
| C.苯中混有苯酚,加浓溴水,然后分液 |
| D.检验氯乙烷中的氯元素,先加NaOH溶液加热,然后再加AgNO3溶液 |
某有机物在空气中完全燃烧时,生成二氧化碳和水的分子个数比为1: 2,则该有机物可能是()
① CH4 ② C2H4 ③ C2H5OH④ CH3OH
| A.①或③ | B.②或③ | C.①或④ | D.②或④ |
下列有机物分子中的各原子不可能在同一平面上的是
| A.苯 | B.四氯化碳 | C.乙烯 | D.乙炔 |
下列有机物的命名中,正确的是:()
| A.1-甲基丙烷 | B.2-乙基丁烷 |
| C.3,3-二甲基丁烷 | D.2-甲基丁烷 |