某元素同位素的单质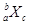 ,极易形成
,极易形成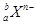 ,下列说法不正确的是( )
,下列说法不正确的是( )
| A.此气体分子中含有的中子数为b-a |
| B.此元素的离子中含有的电子数为a+n |
| C.此气体分子中含有的质子数为c(a+n) |
D.一个该同位素原子的质量约为 g g |
著名化学家徐光宪获得国家最高科学技术奖,以表彰他在稀土萃取理论方面作出的贡献。已知:金属铈(稀土元素)在空气中易氧化变暗,受热时燃烧,遇水很快反应。(注:铈常见的化合价为+3和+4,氧化性:Ce 4+>Fe 3+>I2。)下列说法正确的是()
| A.铈溶于氢碘酸的化学方程式可表示为:Ce + 4HI=CeI4 + 2H2↑ |
| B.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4+ + 2Fe2+= Ce3+ + 2Fe3+ |
| C.在一定条件下,电解熔融状态的CeO2制Ce,在阴极获得铈 |
| D.四种的核素13658Ce、13858Ce、14058Ce、14258Ce,它们互称为同素异形体 |
下列四种判断:①两种弱酸相互反应生成两种强酸;②两种弱酸盐相互作用后生成两种强酸盐;③一种弱酸和一种盐溶液作用后,得到一种强酸和一种盐;④两种酸溶液混合后,溶液的酸性减弱。其中有具体例证的是()
| A.①②③④ | B.①②③ | C.②③④ | D.①③④ |
有一种MCFC型燃料电池,该电池所用燃料为H2和空气,电解质为熔融的 K2CO3。电池的总反应为:2H2 + O2 ="=" 2H2O,负极反应为H2 + CO32—-2e-= H2O + CO2。下列说法中正确的是:
K2CO3。电池的总反应为:2H2 + O2 ="=" 2H2O,负极反应为H2 + CO32—-2e-= H2O + CO2。下列说法中正确的是:
A .正极反应为4OH--4e-= 2H2O + O2↑
.正极反应为4OH--4e-= 2H2O + O2↑
B.放电时,电池中CO32-的物质的量将逐渐减少
C.放电时CO32-向负极移动
D.电路中的电子经正极、负极、熔融的K2CO3后再流回正极,形成闭合回路
分析如下残缺的反应:RO3— + + 6H+=3R2↑+3H2O,下列叙述正确的是
| A.上式中缺项所填物质在反应中作氧化剂 |
| B.RO3—中的R元素在所有的反应中只能被还原 |
| C.R的原子半径在同周期元素原子中最小 |
| D.R一定是周期表中的第ⅤA族元素 |
下列离子方程式中,只能表示一个化学反应的是()
① CO32-+2H+=CO2↑+H2O
② Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
③ Ag++Cl-=AgCl↓④ Fe+Cu2+=Fe2++Cu
⑤ Cl2+H2O=H++Cl-+ HClO
| A.①③ | B.②④ | C.②⑤ | D.只有⑤ |