3,5-二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成。一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5-二甲氧基苯酚的部分物理性质见下表:
| 物质 |
沸点/℃ |
熔点/℃ |
密度(20℃) / g·cm-3 |
溶解性 |
| 甲醇 |
64. 7 |
 |
0. 7915 |
易溶于水 |
| 乙醚 |
34. 5 |
 |
0. 7138 |
微溶于水 |
| 3,5-二甲氧基苯酚 |
 |
33 ~36 |
 |
易溶于甲醇、乙醚,微溶于水 |
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取。①分离出甲醇的操作是的
②萃取用到的分液漏斗使用前需
(2)分离得到的有机层依次用饱和溶液、饱和食盐水、少量蒸馏水进行洗涤。用饱和溶液洗涤的目的是
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是
a.蒸馏除去乙醚 b..重结晶 c.过滤除去干燥剂 d.加入无水干燥
(4)固液分离常采用减压过滤。为了防止倒吸,减压过滤完成后应先
(2012年江苏卷)次硫酸氢钠甲醛(NaHSO2·HCHO·2H2O)在印染、医药以及原子能工业中应用广泛。以Na2SO3、SO2、HCHO 和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
步骤1:在烧瓶中(装置如图所示)加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2,至溶液pH 约为4,制得NaHSO3溶液。步骤2:将装置A 中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80 - 90℃下,反应约3h,冷却至室温,抽滤。步骤3:将滤液真空蒸发浓缩,冷却结晶。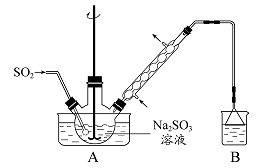
(1)装置B 的烧杯中应加入的溶液是 。
(2)①步骤2 中,反应生成的Zn(OH)2会覆盖在锌粉表面阻止反应进行,防止该现象发生的措施是 。
②冷凝管中回流的主要物质除H2O 外还有 (填化学式)。
(3)①抽滤装置所包含的仪器除减压系统外还有 、 (填仪器名称)。②滤渣的主要成分有 、 (填化学式)。
(4)次硫酸氢钠甲醛具有强还原性,且在120益以上发生分解。步骤3 中不在敞口容器中蒸发浓缩的原因是 。
(2014年浙江卷)葡萄糖酸钙是一种可促进骨骼生长的营养物质。葡萄糖酸钙可通过以下反应制得:
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2
相关物质的溶解性见下表:
| 物质名称 |
葡萄糖酸钙 |
葡萄糖酸 |
溴化钙 |
氯化钙 |
| 水中的溶解性 |
可溶于冷水 易溶于热水 |
可溶 |
易溶 |
易溶 |
| 乙醇中的溶解性 |
微溶 |
微溶 |
可溶 |
可溶 |
实验流程如下:
请回答下列问题:
(1)第①步中溴水氧化葡萄糖时,下列装置最合适的是________。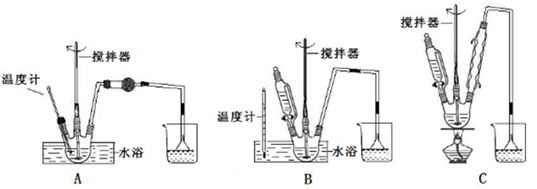
制备葡萄糖酸钙的过程中,葡萄糖的氧化也可用其它试剂,下列物质中最适合的是____。
A.新制Cu(OH)2悬浊液 B.酸性KMnO4溶液
C.O2/葡萄糖氧化酶 D.[Ag(NH3)2]OH溶液
(2)第②步充分反应后CaCO3固体需有剩余,其目的是________;本实验中不宜用CaCl2替代CaCO3,理由是________。
(3)第③步需趁热过滤,其原因是________。
(4)第④步加入乙醇的作用是________。
(5)第⑥步中,下列洗涤剂最合适的是________。
A.冷水B.热水C.乙醇D.乙醇-水混合溶液
(2013年新课标2)正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。
发生的反应如下:CH3CH2CH2CH2OH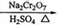 CH3CH2CH2CHO
CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
| 沸点/℃ |
密度/(g·cm-3) |
水中溶解性 |
|
| 正丁醇 |
11.72 |
0.8109 |
微溶 |
| 正丁醛 |
75.7 |
0.8017 |
微溶 |
实验步骤如下:
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90—95℃,在E中收集90℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75—77℃馏分,产量2.0g。
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由 。
(2)加入沸石的作用是 。若加热后发现未加沸石,应采取的正确方法是 。
(3)上述装置图中,B仪器的名称是 ,D仪器的名称是 。
(4)分液漏斗使用前必须进行的操作是 (填正确答案标号)。
a.润湿b.干燥c.检漏 d.标定
(5)将正丁醛粗产品置于分液漏斗中分水时,水在 层(填“上”或“下”)
(6)反应温度应保持在90—95℃,其原因是 。
(7)本实验中,正丁醛的产率为 %。
乙醛在催化剂存在的条件下,可以被空气氧化成乙酸。依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示,试管A中装有40%的乙醛水溶液、铜粉,试管C中装有适量蒸馏水;烧杯B中装有某液体)。已知在60℃~80℃时,用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次,反应基本完全。有关物质的沸点如下:
| 物质 |
乙醛 |
乙酸 |
甘油 |
水 |
| 沸点/℃ |
20.8 |
117.9 |
290 |
100 |

请完成下列问题:
(1)试管A在60℃~80℃时发生的主要反应的化学方程式为(根据题意注明反应条件)
______________________________________________________________________。
(2)如图所示,在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在____________;当试管A内主要反应完成后,温度计水银球的位置应在_____________,目的是____________________________。
(3)烧杯B内盛装甘油,甘油浴的作用是:
_____________________________________,___________________________________。
(4)若想检验试管C中是否含有产物乙酸,请你在所提供的药品中进行选择,设计一个简便的实验方案。所提供的药品有:pH试纸,红色的石蕊试纸,白色的醋酸铅试纸,碳酸氢钠粉末。实验仪器任选。该方案为(简述操作过程)____________________________。
课本介绍了乙醇催化氧化的实验。
(1)甲同学用化学方法替代“闻生成物的气味”来说明生成物的出现,该化学方法中所另加的试剂及出现的主要现象是①试剂:
②现象 。
③方程式
(2)甲同学在探究“闻生成物的气味”的替代方法时,偶然发现向溴水中加入足量的乙醛溶液,可以看到溴水褪色。该同学为解释上述现象,提出三种猜想:
Ⅰ.①溴与乙醛发生取代反应;② ;③由于醛基具有还原性,溴将乙醛氧化为乙酸。请将猜想②填写完全。
Ⅱ.为探究哪种猜想正确,甲同学提出了如下两种实验方案:
方案一:用广泛pH试纸检测溴水褪色后溶液的酸碱性;
这种方法是否能判断出具体的反应原理 (填能或否)
方案二:测定反应前溴水中Br2的物质的量和反应后溶液中Br— 离子的物质的量。
甲同学认为:假设测得反应前溴水中Br2的物质的量为amol,若测得反应后n(Br—)= mol,则说明溴与乙醛发生取代反应。