金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用。完成下列填空:
(1)铝原子核外电子云有种不同的伸展方向,有 种不同运动状态的电子。
(2)镓()与铝同族。写出镓的氯化物和氨水反应的化学方程式。
(3)硅与铝同周期。是硅酸盐玻璃()的主要成分,也可写成。盛放溶液的试剂瓶若用玻璃瓶塞容易形成粘性的硅酸盐而无法打开,发生反应的化学方程式。
长石是铝硅盐酸,不同类长石其氧原子的物质的量分数相同。由钠长石化学式可推知钙长石的化学式为
(4)用铝和金属氧化物反应制备金属单质是工业上较常用的方法。如:
 ↑
↑
常温下的金属性比的金属性(选填"强""弱")。利用上述方法可制取的主要原因是 。
a.高温时的活泼性大于 b.高温有利于分解
c.高温时比稳定 d.的沸点比的低
完成下列物质的电离方程式(1)NaHSO4 (2)NaHSO3 (3)NaH2PO4
A、B、C、D均为中学化学中常见的物质,它们之间转化关系如下图(部分产物已略去):试回答: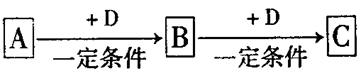
(1)若D是具有氧化性的单质,则属于主族的金属A为 ________ (填元素符号),C的电子式为__________
(2)若A是某物质的稀溶液,D是金属,C溶液在储存时应加入少量D,其理由是(用必要的文字和离子方程式表示)____________;D在潮湿的空气中易发生吸氧腐蚀,写出腐蚀时原电池正极的电极反应式___________。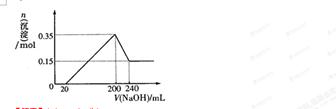
(3)若A、B、C为含同一种金属元素的无机化合物,在溶液中A和C反应生成B。请写出B转化为C的所有可能的离子方程式_____________________。化合物B经过一系列反应可以得到单质E,将一定质量的Mg和E 的混合物投入500mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如右图所示。则固体混合物中Mg的质量为________;NaOH溶液的物质的量浓度为 ________。硫酸溶液的物质的量浓度为_______。
Ⅰ.2011年4月27日某市工商局查获400克袋装中老年补钙营养奶粉1 401包。这种奶粉被鉴定为所含亚硝酸盐残留量高出正常值7.8倍,长期食用可能致癌。已知NaNO2能发生如下反应:2NaNO2+4HI===2NO↑+I2+2NaI+2H2O。
(1)上述反应中氧化剂是_____,若有0.75 mol的还原剂被氧化,则被还原的氧化剂有_____mol。
(2)根据上述反应,可以用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl,可选用的物质有:①自来水;②淀粉碘化钾试纸;③淀粉;④白糖;⑤食醋;⑥白酒。进行实验时,必须选用的物质有____________。
(3)某工厂废切削液中含有2%~5%的NaNO2,直接排放会造成污染,下列试剂中_____(填序号)能使NaNO2转化为不引起二次污染的N2反应的化学方程式为________________________ (并标出电子转移的数目和方向)。
①NaCl ②NH4Cl ③H2O2 ④浓H2SO4
(4)下列离子在溶液中一定能大量共存的是________。
A.NH Cl- OH- CO Cl- OH- CO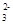 |
B.Fe2+ NO3- Cl- H+ |
C.CH3COO- NH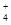 H+ Cl- H+ Cl- |
D.CH3COO- Na+ Cl- SO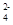 |
Ⅱ.实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应式为
4CuI+Hg===Cu2HgI4+2Cu。
(1)上述反应产物Cu2HgI4中,Cu元素是________价。
(2) CuI可由Cu2+与I-直接反应制得,请配平下列反应的离子方程式: Cu2++
Cu2++ I-===
I-=== CuI+
CuI+ I
I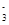
某无色透明溶液,跟金属铝反应放出H2,试判断下列离子: Mg2+、Cu2+、Ba2+、H+、Ag+、SO42-、SO32-、HCO3-、OH-、NO3-,何者能存在于此溶液中?
(1)当生成Al3+时,一定存在__________,可能存在__________
(2)当生成AlO2-时,一定存在__________,可能存在__________
实验室欲用NaNO3固体配制80 mL 1.4 mol·L-1的NaNO3溶液,试回答:
(1)用不到的仪器是__________;
A.烧杯B.500 mL容量瓶 C.量筒
D.胶头滴管 E.玻璃棒 F.100 mL容量瓶
(2)配制时应称取NaNO3__________g;
(3)实验开始时,需检查容量瓶__________;
(4)在配制一定物质的量浓度溶液的实验中,下列操作对所配溶液浓度无影响的是(写字母) __________;会使所配溶液浓度偏大的是__________;会使所配溶液浓度偏小的是__________。
A.在烧杯中溶解溶质,搅拌时不慎溅出少量溶液
B.未将洗涤烧杯内壁的溶液转移入容量瓶
C.容量瓶中所配的溶液液面未到刻度线便停止加水
D.将配得的溶液从容量瓶转移到干燥、洁净的试剂瓶中时,有少量溅出
E.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
F.容量瓶中液面将达到刻度线时,俯视刻度线和液面