部分弱酸的电离平衡常数如下表:
| 弱酸 |
|||
| 电离平衡常数 (25) |
=1.77×10-4 |
=4.9×10-10 |
=4.3×10-7 =5.6×10-11 |
下列选项错误的是
| A. | |
| B. |
↑ |
| C. |
中和等体积、等的和消耗的量前者小于后者 |
| D. |
等体积、等浓度的和溶液中所含离子总数前者小于后者 |
已知氧化性:HClO>Cl2>Fe3+>SO42-;常温下,电离常数:K(H2CO3)>K(HClO)>K(HCO3-)>K[Al(OH)3];则下列相关离子方程式正确的是
| A.0.5mol/L的NaHSO3溶液与1.0mol/L的NaClO溶液等体积混合: HSO3-+ClO-=SO42-+Cl-+H+ |
| B.小苏打溶液与偏铝酸钠溶液混合:HCO3-+AlO2-+H2O=Al(OH)3↓+CO32- |
| C.“84”消毒液(主要成分为NaClO)露置在空气中变质: 2ClO-+CO2+H2O=CO32-+2HClO |
| D.在“84”消毒液中滴加FeSO4溶液:2Fe2++ClO-+H2O=2Fe3++Cl-+2OH- |
下列各组关于强电解质、弱电解质、非电解质的分类完全正确的是
| 选项 |
A |
B |
C |
D |
| 强电解质 |
Fe |
NaCl |
CaCO3 |
HNO3 |
| 弱电解质 |
CH3COOH |
NH3 |
HF |
Fe(OH)3 |
| 非电解质 |
蔗糖 |
BaSO4 |
CO2 |
H2O |
能说明醋酸是弱电解质的事实是
| A.醋酸溶液的导电性比盐酸弱 |
| B.醋酸溶液与碳酸钙反应,缓慢放出二氧化碳 |
| C.醋酸溶液用水稀释后,氢离子浓度下降 |
| D.0.1mol/L的CH3COOH溶液中,氢离子的浓度约为0.001mol/L |
下列说法正确的是
| A.体积、pH均相同的醋酸和盐酸完全溶解等量的镁粉(少量),后者用时少 |
B.0.1 mol·L-1的醋酸溶液加水稀释, 减小 减小 |
| C.向水中加入少量固体硫酸氢钠,c(H+)增大,KW变大 |
| D.常温下,V1 L pH=11的NaOH溶液与V2 L pH=3的HA溶液混合,若混合液显中性,则V1≤V2 |
高铁电池是一种可逆电池,该电池能长时间保持稳定的放电电压。高铁电池总反应为3Zn+2K2FeO4+8H20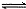 3Zn(OH)2+2Fe(OH)3+4KOH。下列判断不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH。下列判断不正确的是
| A.放电时,负极反应为Zn-2e-+2OH一=Zn(OH)2 |
| B.充电时,阴极pH增大 |
| C.放电时,若有6mol电子转移,则正极有10 mol OH一移向负极 |
| D.充电时,阳极反应为Fe(OH)3+5OH一+3e一=FeO42-+4H2O |