某恒温密闭容器中,可逆反应()  +()-达到平衡。缩小容器体积,重新达到平衡时,()的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
+()-达到平衡。缩小容器体积,重新达到平衡时,()的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
| A. |
产物的状态只能为固态或液态 |
| B. |
平衡时,单位时间内()消耗﹕()消耗=1﹕1 |
| C. |
保持体积不变,向平衡体系中加入,平衡可能向逆反应方向移动 |
| D. |
若开始时向容器中加入1和1,达到平衡时放出热量 |
控制适当的条件,将反应Fe3++Ag=Fe2++Ag+设计成如图所示的原电池(盐桥装有琼脂-硝酸钾溶液;灵敏电流计的0刻度居中,左右均有刻度)。已知接通后观察到电流计指针向右偏转。下列判断正确的是
| A.在外电路中,电子从石墨电极流向银电极 |
| B.盐桥中的K+移向乙烧杯 |
| C.一段时间后,电流计指针反向偏转,越过0刻度,向左边偏转 |
| D.电流计指针居中后,往甲烧杯中加入一定量的铁粉,电流计指针将向左偏转 |
对于反应CO(g)+H2O(g) CO2(g)+H2(g) △<0,在其它条件不变的情况下
CO2(g)+H2(g) △<0,在其它条件不变的情况下
| A.加入催化剂,改变了反应的途径,反应的△H也随之改变 |
| B.改变压强,平衡不发生移动,反应放出的热量不变 |
| C.升高温度,反应速率加快,反应放出的热量不变 |
| D.若在原电池中进行,反应放出的热量不变 |
设NA为阿伏加德罗常数的值。下列叙述正确的是
| A.标准状况下,22.4LCCl4中含有的分子数目为NA |
| B.7.8gNa2S和Na2O2的混合物中,含有的阴离子数目为0.1NA |
| C.足量的铜与含有0.2molH2SO4的浓溶液共热可生成SO2为0.1NA |
| D.标准状况下,2.24LCl2与足量的NaOH溶液反应,转移的电子数目为0.2NA |
对于下图所示实验,下列实验现象预测或操作正确的是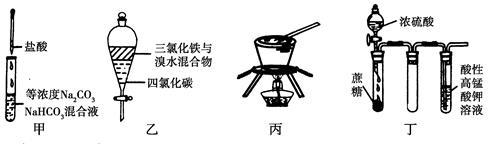
| A.实验甲:逐滴滴加盐酸时,试管中立即产生大量气泡 |
| B.实验乙:充分振荡后静置,下层溶液为橙红色,上层为无色 |
| C.实验丙:从饱和食盐水中提取NaCl晶体 |
| D.装置丁:酸性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅乃至褪去 |
25℃时,将amol/L一元酸HA与bmol/LNaOH溶液等体积混合后测得溶液pH=7,则下列关系一定不正确的
| A.c(A-)<c(Na+) | B.a>b |
| C.c(A-)=c(Na+) | D.a="b" |