利用化石燃料开采、加工过程产生的废气制取氢气,既廉价又环保。
(1)工业上可用组成为的无机材料纯化制取的氢气
①已知元素、均位于元素周期表中第3周期,两种元素原子的质子数之和为27,则的原子结构示意图为
②常温下,不能与单质发生反应的是(填序号)
a.溶液 b. c.浓硫酸 d. e.固体
(2)利用废气制取氢气来的方法有多种
①高温热分解法
已知:在恒温密闭容器中,控制不同温度进行分解实验。以起始浓度均为测定的转化率,结果见右图。图中a为的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时的转化率。据图计算985℃时按上述反应分解的平衡常数=_;说明温度的升高,曲线b向曲线a逼近的原因:

 ②电化学法
②电化学法
该法制氢过程的示意图如右。反应池中反应物的流向采用气、液逆流方式,其目的是;反应池中发生反应的化学方程式为。反应后的溶液进入电解池,电解总反应的离子方程式为_。
碳、氮、氧是地球上丰富的元素。
(1)C、N、O的第一电离能由大到小的顺序为(用元素符号表示)_________。
(2)前四周期元素中,基态原子未成对电子数与氮相同的元素有_________种。
(3)试判断NH3溶于水后,形成NH3·H2O的合理结构:_______(填字母代号),推理依据是____ ___________。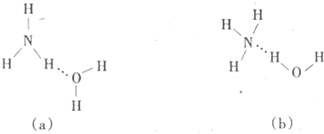
(4)H2O分子与H+结合的过程中未发生改变的是_________(填序号)。
a.微粒的空间构型 b.O原子的杂化方式 c.H—O—H的键角
(5)C60晶体(其结构模型如图)中每个C60分子周围与它距离最近且等距离的C60分子有__________个。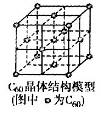
物质的结构是决定物质性质的重要因素。请回答下列问题:
(1)基态Ni原子核外电子排布式为____________;第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是_________________。
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分为0.069nm和0.078nm,则熔点NiO_____________FeO(填“<”或“>”);NiO晶胞中Ni2+的配位数为____________。
(3)肼可用作火箭燃料,燃烧时发生的反应是:N2O4+2N2H4=3N2+4H2O,若该反应中有4molN—H键断裂,形成的 键有________mol。
键有________mol。
煤是重要的能源,也是化工生产的重要原料。
(1)煤燃烧产生的废气直接排放到空气中,可能导致的环境污染问题是_____________。
(2)下图是对煤矿燃烧产生的废气进行常温脱硫处理的流程示意图。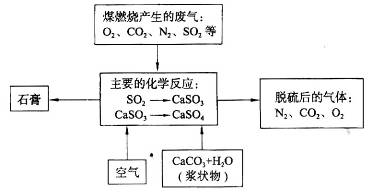
①废气脱硫过程中,主要反应的化学方程式为______________、_____________;
②在煤矿中直接添加一种物质,可有效减少煤矿燃烧产生的SO2,该物质是___________;
③石膏的工业生产中的用途是_________________(写出一种用途即可)。
(3)煤经过___________(填加工方法)可以得到焦炉煤气、煤矿焦油和焦炭。煤焦油经过_______(填加工方法)可得到芳得族化合物。煤矿也可以用氢化法转化燃油,氢化法的本质是__________________。
人工固氮是指将氮元素由游离态转化为化合态的过程。
I.最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实验氮的固定一电解法合成氨,大大提高了氮气和氢气的转化率。总反应式为:N2(g)+3H2(g) 2NH3(g),则在电解法合成氨的过程中,应将H2不断地通入_________极(填“阴”或“阳”) ;向另一电极通入N2,该电极的反应式为__________________________。
2NH3(g),则在电解法合成氨的过程中,应将H2不断地通入_________极(填“阴”或“阳”) ;向另一电极通入N2,该电极的反应式为__________________________。
II.据报道,在一定条件下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,主要产物为NH3,相应的反应方程式为:2N2(g)+6H2O(g) 4NH3(g)+3O2(g)△H=Q。
4NH3(g)+3O2(g)△H=Q。
(1)上述反应的平衡常数表达式为_______________。
(2)取五份等体积N2和H2O的混合气体(物质的量之比均为1:3),分别加入体积相同的恒容密闭容器中,在温度不相同的情况下发生反应,反应相同时间后,测得氮气的体积分数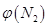 与反应温度T的关系曲线如图所示,则上述反应的Q________0(填“>”、“<”或“=”)。
与反应温度T的关系曲线如图所示,则上述反应的Q________0(填“>”、“<”或“=”)。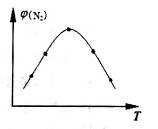
(3)若上述反应在有催化剂的情况下发生,则下图所示的a、b、c、d四条曲线中,能表示反应体系能量变化的是_______(选填字母代号),图中△H的绝对值为1530kJ·mol-1。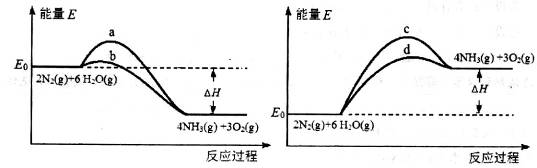
III.目前工业合成氨的原理是:N2(g)+3H2(g) 2NH3(g)△H=-93.0kJ/mol。
2NH3(g)△H=-93.0kJ/mol。
回答下列问题:
(1)结合II中的数据,则O2(g)+2H2(g)=2H2O(g)的△H=______________。
(2)在一定温度下,将1molN2和3mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8mol。
①达平衡时,H2的转化率α1=______________。
②在相同条件下,若起始时只将NH3置于该容器中,达到平衡状态时NH3的转化率为α2,当α1+α2=1时,则起始时NH3的物质的量n(NH3)=_____________mol。
某工业废水中含有CN-和Cr2O 等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:
等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:
回答下列问题:
(1)步骤②中,CN-被ClO-氧化为CNO-的离子方程式为________________。
(2)步骤③的反应为S2O32-+Cr2O72-+H+ SO42-+Cr3++H2O(未配平),则每消耗0.4mol Cr2O72-转移__________mol e-。
SO42-+Cr3++H2O(未配平),则每消耗0.4mol Cr2O72-转移__________mol e-。
(3)含Cr3+废水可以加入熟石灰进一步处理,目的是____________________。
(4)在25℃下,将amol/L的NaCN溶液与0.01mol/L的盐酸等体积混合,反应后测得溶液pH=7,则a________0.01(填“>”、“<”或“=”);用含a的代数式表示HCN的电离常数Ka=_________________。
(5)取工业废水水样于试管中,加入NaOH溶液观察到有蓝色沉淀生成,继续加至不再产生蓝色沉淀为止,再向溶液中加入足量Na2S溶液,蓝色沉淀转化成黑色沉淀。该过程中反应的离子方程是________。