为了探究的氧化性和热稳定性,某化学兴趣小组设计了如下实验。
Ⅰ.的氧化性
将光亮的铁丝伸入溶液中,一段时间后将铁丝取出。为检验溶液中的氧化产物,将溶液中的除尽后,进行了如下实验。可选用第试剂溶液、溶液、氯水。
(1)请完成下表:
| 操作 |
现象 |
结论 |
| 取少量除尽后的溶液于试管中,加入溶液,振荡 |
存在 |
|
| 取少量除尽后的溶液于试管中,加入,振荡 |
存在 |
【实验结论】的氧化产物为存在和
Ⅱ. 的热稳定性性
用下图所示的实验装置A加热固体,产生红棕色气体,在装置D中收集到无色气体。当反应结束以后,试管中残留固体为黑色。
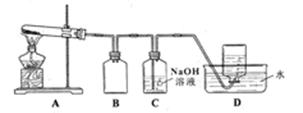
(2)装置B的作用是
(3)经小组讨论并验证该无色气体为,其验证方法是
(4)【查阅资料】和粉末的均为黑色;可溶于氨水。
【提出假设】试管中残留的黑色固体可能是:ⅰ;ⅱ.;ⅲ.和
【实验验证】该小组为验证上述设想,分别取少量黑色固体,进行了如下实验。
| 实验编号 |
操作 |
现象 |
| a |
加入足量氨水,振荡 |
黑色固体不溶解 |
| b |
加入足量稀硫酸,振荡 |
黑色固体溶解,并有气体产生 |
【实验评价】根据上述实验,不能确定固体产物成分的实验是(填实验编号)。
【实验结论】根据上述实验结果,该小组得出的固体热分解的产物有。
某课外活动小组模拟呼吸面具中的原理(过氧化钠与潮湿二氧化碳反应),设计用下图所示的仪器来制取氧气并测量氧气的体积。图中量气装置E是由甲、乙两根玻璃管组成,它们用橡皮管连通,并装入适量水。甲管有刻度(0~50mL),供量气用;乙管可上下移动,以调节液面高低。实验室可供选用的药品还有:稀硫酸、盐酸、过氧化钠、大理石、水。试回答:
(1)图中装置的连接顺序是(填各接口的编号),其中连接胶管及夹持装置均省略:
______________________________________________。
(2)装置C中放入的反应物是________________和_____________。
(3)装置A的作用是_____________;装置B的作用是______________。
(4)为了较准确地测量氧气的体积,除了必须检查整个装置的气密性之外,在读反应前后甲管中液面的读数求其差值的过程中,应注意________和_______。
a.视线与凹液面最低处相平
b.等待片刻,待乙管中液面不再上升时,立刻读数。
c.读数时应上下移动乙管,使甲、乙两管液面相平。
d.读数时不一定使甲、乙两管液面相平。
三位学生设计了下述三个方案,并都认为如果观察到的现象和自己设计的方案一致,即可证明某无色溶液中有SO42-;。
方案1:试液————→BaCl2溶液白色沉淀————→足量HNO3沉淀不溶解
方案2:试液————→足量稀盐酸白色沉淀————→BaCl2溶液沉淀不溶解
方案3:试液————→足量HNO3白色沉淀————→Ba(NO3沉淀不溶解
试评价上述方案是否严密,并说明理由。
为了制取干燥纯净的气体C,可用如下图所示装置。生成C的速度可通过调节滴入液体A的速度的方法来控制,已知C是一种无色无味、不能使酸碱指示剂变色,也不会在空气中燃烧的气体。
(1)C气体是____________。
(2)若B是一种淡黄色固体,则烧瓶中发生反应的化学方程式为________________________。
(3)若B是一种黑色粉末,则A液体是________,B物质的作用是______________________。
(4)洗气瓶中的D液体是____________,作用是__________________________________。
碱金属与O2反应生成的氧化物比较复杂:有普通氧化物,如Na2O;过氧化物,如Na2O2;超氧化物,如KO2;臭氧化物,如RbO3。其中后三种均可与水或CO2反应生成氧气。要制备普通氧化物,一般要用碱金属单质还原对应的过氧化物、硝酸盐或亚硝酸盐。
(1)用化学反应方程式表示①钠与Na2O2反应__________________________。②钾与硝酸钾反应:_____________________。③RbO3与CO2反应:______________________________。
(2)若用锥形瓶收集一瓶CO2气体,在瓶内有一只扎紧在玻璃管末端的气球,如下图。打开塞子迅速往瓶里加入一种物质后,立即塞紧塞子,一段时间后气球就会自动膨胀,该物质可能是
| A.Na2O | B.Na2O2 | C.KO2 | D.RbO3 |
现有CaCO3和KHCO3的混合物,甲、乙两同学分别称取一定质量的该混合物来测定其中两种成分的质量比(已知K2CO3的分解温度远大于1000 ℃;气体体积均已折算成标准状况):
(1)甲同学取2.00 g混合物,并向其中加入过量的2.00 mol·L-1的盐酸,生成气体a mL。则a=____________(填数字),据此甲同学____________(填“能”或“不能”)计算出混合物两成分的质量比。若能,则m(CaCO3)∶m(KHCO3)=____________;若不能,此空不必作答。
(2)乙同学称取W g混合物充分加热,所得CO2气体的体积随温度变化的曲线如图所示,则m(CaCO3)∶m(KHCO3)=____________(请用含b、c的代数式表示)。