醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:

可能用到的有关数据如下:

合成反应:
在中加入20环己醇和2小片碎瓷片,冷却搅动下慢慢加入1浓硫酸。中通入冷却水后,开始缓慢加热,控制馏出物的温度不超过90℃。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10。
回答下列问题:
(1)装置的名称是。
(2)加入碎瓷片的作用是;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作时(填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为。
(4)分液漏斗在使用前须清洗干净并;在本实验分离过程中,产物应该从分液漏斗的(填"上口倒出"或"下口放出")。
(5)分离提纯过程中加入无水氯化钙的目的是。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有(填正确答案标号)。
A.圆底烧瓶 B.温度计 C.吸滤瓶 D.球形冷凝管 E.接收器
(7)本实验所得到的环己烯产率是(填正确答案标号)。
A.41% B.50% C.61% D.70%
铁是广泛应用的金属。
(1)铁元素在周期表中的位置是,工业上通常采用高炉炼铁的方法制得单质铁,请写出用赤铁矿与CO反应炼铁的化学方程式。
(2)请补充完成实验室制备Fe(OH)3胶体的操作步骤:
①取25ml蒸馏水加热至沸腾
②
③继续煮沸至
④停止加热。
(3)几种离子生成氢氧化物沉淀的pH如下表(已知Fe(OH)2呈絮状,不易从溶液中除去)
注:开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算现有某溶液含有Fe2+、Fe3+、Zn2+、SO42-,要使溶液中的Fe2+和Fe3+完全沉淀,需往溶液中先加入H2O2,作用是,然后再加入NH4HCO3调节pH至 ,NH4HCO3中起调节pH作用的离子是 (填离子符号)
①设计实验探究铁钉和钢钉在碱性溶液中遇到高锰酸钾时是否能发生电化学腐蚀。实验如下
①完成下列表格
②实验2比实验1能够较快看到以上现象的原因是。
二氯化锡是一种重要的电镀原料,又称氯化亚锡。分子式为SnCl2,其沸点为623℃,在水溶液中以SnCl2·2H2O的形式析出。锡的另一种氯化物SnCl4的沸点为114℃。某锡花中(主要成分为锡)含有杂质钡、锑、铜、铅等金属。从锡花中制备二氯化锡晶体工艺如下:
(1)滤渣成分为(用化学式表示)。
(2)经过氯化后的锡主要以SnCl4的形式存在混合液中。写出锡与SnCl4反应的化学方程式。
(3)反应Ⅰ进行反应时,加热反应器使反应液温度升高至600C,开始通入Cl2,随着反应的进行,反应所放出的热量使溶液的温度提高,此时需保持反应温度在80℃~90℃之间,不宜过高。请解释
①温度不宜过高的原因是;
②开始通入氯气时,气体流量不宜过大,随反应的进行逐渐加大氯气的通入量,此操作的目的是。
(4)母液中含有的离子有H+、OH-、。
(16分)用芒硝(Na2SO4·10H2O)制备纯碱、铵明矾[NH4Al(SO4)2·12H2O]的生产工艺流程图如下所示: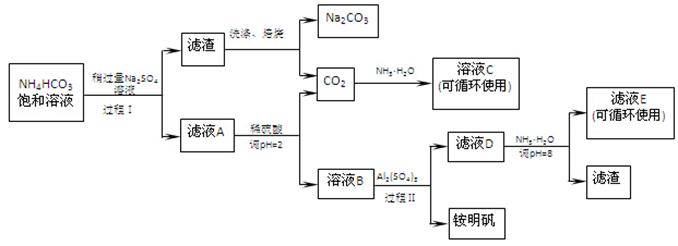
(1)溶液C中的溶质主要是。
(2)铵明矾的溶液呈性,铵明矾可用于净水,用离子方程式说明原理。
(3)过程Ⅰ反应温度不能超过40℃,主要原因是。
(4)运用化学平衡原理解释Na2SO4溶液稍过量的原因
(5)滤液E中溶质离子为
(6)写出工艺流程中焙烧的反应方程式
某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)
(1)装置B中发生反应的化学方程式是。
(2)装置E中的现象是。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法:
(4)该小组利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:滤液(步骤I)→FeCl3溶液(步骤II)→FeCl3·6H2O晶体
①步骤I中通入Cl2的作用是。
②步骤II从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括:。③该流程中需保持盐酸过量,主要原因是(结合离子方程式简要说明)________________
(14分)空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:
(1)步骤①中用硫酸酸化的目的是____________________________________________。
步骤②发生反应的离子方程式为_____________________________________________。
(2)步骤④利用了SO2的还原性,反应的离子方程式为___________________________。
(3)操作⑥的名称是________________。
(4)从含溴海水中吹出的溴也可用纯碱吸收。纯碱吸收溴的主要反应是:Na2CO3+Br2→NaBrO3+NaBr+CO2,吸收1molBr2时,转移的电子数为________mol。纯碱吸收后再用硫酸酸化,单质溴又从溶液中析出。
(5)化学上将SCN 、OCN
、OCN 、CN
、CN 等离子称为“类卤离子”。现将KSCN溶液滴加到酸性Fe3+溶液中,溶液立即变成血红色;通入SO2后,血红色消失。血红色消失过程中发生反应的离子方程式为______________________________________。
等离子称为“类卤离子”。现将KSCN溶液滴加到酸性Fe3+溶液中,溶液立即变成血红色;通入SO2后,血红色消失。血红色消失过程中发生反应的离子方程式为______________________________________。