在下列物质中属于同一种物质的有 、 ;互为同分异构体的有 、 。
(1)液氯 (2)氯气 (3)白磷 (4)红磷 (5)D (6)T
(7) 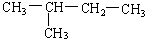 (8)
(8) 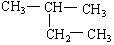 (9)新戊烷
(9)新戊烷
反应3Fe(S)+4H2O====Fe3O4(s)+4H2(g),在一可变的容积的密闭容器中进行,试回答:
(1)增加Fe的量,其正反应速率的变化是(填增大、不变、减小,以下相同)
(2)将容器的体积缩小一半,其正反应速率,逆反应速率。
(3)保持体积不变,充入N2使体系压强增大,其正反应速率,逆反应速率。
(4)保持压强不变,充入N2使容器的体积增大,其正反应速率逆反应速率。
可逆反应aA(g)+bB(g)  pC(g),反应时间与C%(产物C的体积分数)函数关系如图所示。A图表示压强不同的曲线,B图表示的是温度不同的曲线,试比较下列大小关系:P1______ P2,T1______ T2,ΔH_____ 0,a+b______ p。
pC(g),反应时间与C%(产物C的体积分数)函数关系如图所示。A图表示压强不同的曲线,B图表示的是温度不同的曲线,试比较下列大小关系:P1______ P2,T1______ T2,ΔH_____ 0,a+b______ p。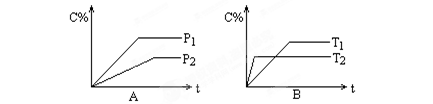
依据事实,写出下列反应的热化学方程式。
(1)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为___________________________________________
(2)若适量的N2和O2完全反应,每生成23g NO2需要吸收16.95kJ__________
(3)已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________
四种短周期元素在周期表中的相对位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。
| X |
Y |
|
| Z |
W |
请回答下列问题:
(1)元素Z位于周期表中第______________周期,___________族;
(2)这些元素的氢化物中,水溶液碱性最强的是_______________(写化学式);
(3)XW2的电子式为_______________;
(4)Y的最高价氧化物的化学式为________________;
(5)W和Y形成的一种二元化合物具有色温效应,请相对分子质量在170~190之间,且W的质量分数约为70%。该化合物的化学式为_________________。
学习化学应该明确“从生活中来,到生活中去”道理。在生产生活中,我们会遇到各种各样的化学反应。
(1)请你写出发酵粉中的主要钠盐的化学式______________。
(2)工业上用氯气和消石灰(氢氧化钙乳浊液)反应制取漂白粉(主要成分是氯化钙和次氯酸钙)请写出其反应的化学方程式。
(3)请你写出下列反应的离子方程式。
胃舒平含有氢氧化铝,可用来治疗胃酸(盐酸)过多。
将铁加入硫酸铜溶液中炼铜(湿法炼铜)。