在0.1 mol·L-1CH3COOH溶液中存在如下电离平衡:CH3COOH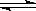 CH3COO-+H+,对于该平衡,下列叙述正确的是
CH3COO-+H+,对于该平衡,下列叙述正确的是
| A.加入水时,平衡向逆反应方向移动 |
| B.加入少量NaOH固体,平衡向正反应方向移动 |
| C.加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减小 |
| D.加入少量CH3COONa固体,平衡向正反应方向移动 |
下列说法正确的是
| A.凡是放热反应都是自发的 |
| B.铁在潮湿空气中生锈是自发过程 |
| C.自发反应都是熵增大的反应 |
| D.电解池的反应是属于自发反应 |
下列反应的离子方程式正确的是()
A.苯酚钠溶液中通入少量二氧化碳: |
| B.等体积、等浓度的Ca(HCO3)2溶液和NaOH溶液混合: Ca2++ 2HCO3- + 2OH- = CaCO3↓+ CO32- + 2H2O |
| C.碳酸锌溶于稀硝酸中:CO32-+ 2H+= H2O + CO2↑ |
| D.少量Cl2通入KI溶液中:Cl2+ 2I- = 2C1- + I2 |
下列实验中,有关仪器的下端必须插入液面以下的是()
①制备乙烯时用的温度计 ②制备氯气装置中的分液漏斗 ③制备氨水时将氨气溶于水的导管 ④制备氢气的简易装置中加入稀硫酸用的长颈漏斗 ⑤分馏石油时的温度计 ⑥制备乙酸乙酯时,将乙酸乙酯蒸气通入饱和Na2CO3溶液的导管
A.①②④  |
B.①④ | C.①②③⑥ |
D.①②③④ |
下列关于实验原理、操作的叙述,不正确的是( )
| A.排水法收集的CO2要比排空气法收集的CO2纯度高,所以我们首选排水法收集 |
| B.配制溶液时,俯视刻度线来定容,会使得所配溶液浓度偏高 |
| C.纸层析实验中,滤纸上的试样点可以用毛细管来点,使试样点的面积小 |
| D.除去乙酸乙酯中的乙酸,可以用饱和的碳酸钠溶液 |
丙泊酚,其化学名为2,6—双异丙基苯酚,是目前临床上普遍用于麻醉诱导、麻醉维持、ICU危重病人镇静的一种新型快速、短效静脉麻醉药。其结构如图:
关于丙泊酚,下列说法正确的是()
| A.分子式为C10H20O |
| B.分子中所有碳原子可能在同一平面中 |
| C.该物质的1H核磁共振谱图中有5个特征峰,峰值强度比大概为:1:1:2:2:12 |
| D.该物质结构中有2个手性碳原子 |