100mL 0.1 mol·L-1醋酸与50mL 0.2 mol·L-1氢氧化钠溶液混合,在所得溶液中
| A.C(Na+)>C(CH3COO-)>C(OH-)>C(H+) |
| B.C(Na+)>C(CH3COO-)>C(H+)>C(OH-) |
| C.C(Na+)>C(CH3COO-)>C(H+)=C(OH-) |
| D.C(Na+)=C(CH3COO-)>C(OH-)>C(H+) |
化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是 ( )
A.CO2的电子式 |
B.Cl-的结构示意图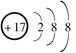 |
| C.乙烯的结构简式C2H4 |
D.NH4Cl的电子式为: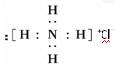 |
环境问题已成为人类社会面临的重大威胁,各种污染数不胜数.下列名词与环境问题无关的是 ①温室效应 ②赤潮 ③酸雨 ④光化学污染 ⑤臭氧空洞 ⑥水俣病 ⑦潮汐 ⑧大脖子病()
| A.①② | B.⑦⑧ | C.⑥⑦⑧ | D.②⑤⑦ |
右图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加一滴石蕊溶液。下列实验现象中正确的是()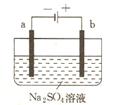
| A.逸出气体的体积,a电极的小于b电极的 |
| B.一电极逸出无味气体,另一电极逸出刺激性气味气体 |
| C.a电极附近呈红色,b电极附近呈蓝色 |
| D.a电极附近呈蓝色,b电极附近呈红色 |
一种新型燃料电池,以镍板为电极插入KOH溶液中,分别向两极通入乙烷和氧气。电极反应式为:C2H6 +180H- -14e-="=" 2C032一+ 12H20; 7H20+7/2 02+14e - ="=140H" -.
下列有关此电池的推断错误的是()
| A.通氧气的电极为正极 |
| B.参加反应的02与C2H6的物质的量之比为7:2 |
| C.放电一段时间后,KOH的物质的量浓度将下降 |
| D.在电解质溶液中OH -向正极移动 |
亚氨基锂(Li2NH)是一种储氢容量高、安全性好的固体储氢材料,其储氢原理可表示为:Li2 NH+ H2= LiNH2+ LiH,下列有关说法正确的是()
| A.Li2NH中N的化合价是-l | B.该反应中H2既是氧化剂又是还原剂 |
| C.Li+和H-的离子半径相等 | D.此法储氢和钢瓶储氢的原理相同 |