人体血液的正常pH约为7.35~7.45,若在外界因素作用下突然发生改变就会引起“酸中毒”或“碱中毒”,甚至有生命危险。由于人体体液的缓冲系统中存在如下平衡:
H++HCO3- H2CO3
H2CO3 CO2+H2O
CO2+H2O
H++PO43- HPO42-
HPO42-
H++HPO42- H2PO4-
H2PO4-
故能维持血液pH的相对稳定,以保证正常生理活动。下列说法中不合理的是
| A.当强酸性物质进入人体的体液后,上述缓冲系统的平衡向右移,从而维持pH稳定 |
| B.当强碱性物质进入人体的体液后,上述缓冲系统的平衡向左移,从而维持pH稳定 |
| C.某病人在静脉滴注的大量生理盐水后,血液被稀释,会导致c(H+)显著减少,pH值显著增大,可能会引起碱中毒 |
| D.在人体进行呼吸活动时,如CO2进入血液,会使平衡向左移动,c(H+)增大,pH值略减小 |
一定温度下,在密闭容器内有如下化学反应平衡:CO+H2O(g)  H2+CO2。向容器内加入1molCO和1mol H2O(g)时,生成2/3mol CO2如果通入的H2O(g)改为4mol时,在上述条件下,生成CO2的物质的量为
H2+CO2。向容器内加入1molCO和1mol H2O(g)时,生成2/3mol CO2如果通入的H2O(g)改为4mol时,在上述条件下,生成CO2的物质的量为
| A.0.5mol | B.0.6mol | C.0.9mol | D.2.5mol |
对以下实验装置图的说法正确的是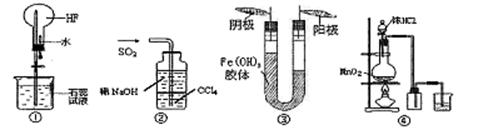
| A.利用图①装置做喷泉实验 |
| B.利用图②装置吸收尾气SO2 |
| C.利用图③装置进行胶体电泳实验可以说明Fe(OH)3胶体带正电荷 |
| D.利用图④装置用MnO2和浓盐酸制备并收集Cl2 |
下列说法正确的是
| A.原子的第一电离能越大,该元素的电负性就越大 |
| B.原子的电子层数越多,原子半径越大 |
| C.原子失去电子越多,说明其还原性越强 |
| D.同一原子的能层越高,S电子云的半径越大 |
常温下,下列各组离子在指定溶液中能大量共存的是
| A.H2S溶液中: Br-、Na+ 、SO42-、Hg2+ |
| B.c(H+)=l×l0-13mol/L的溶液中:K+ 、Cl-、SO42-、 C6H5O- |
| C.与铝反应产生大量氢气的溶液中: NO3-、I- 、Al3+、Na+ |
| D.含有0.1mol/L Fe3+的溶液中: CO32-、NH4+、 NO3-、 Na+ |
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.1mol 1-丁炔中,含2NA个π键,9NA个σ键 |
| B.在O2参与的反应中,1mol O2作氧化剂时得到的电子数一定是4NA |
| C.22.4LHC1溶于水时,有NA个共价键发生断裂 |
| D.17 g甲基(-14CH3)所含电子数为10NA |