按要求回答:
(1)写出电离方程式:
NaHCO3_______________________________________________________________________
H2S__________________________________________________________________________
(2)写出水解的离子方程式:
Na2CO3________________________________________________________________________
(3)用pH试纸测定0.1 mol·L-1的纯碱溶液的pH,其正确的操作是
__________________________________________________________________________________。
(4)氯化铝水溶液呈 性(填酸性、中性、碱性),原因是(用化学方程式表示):_____________________ _______________________________________________ ______ 。把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(5)实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)Ag+水解。
(6)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,充分反应后溶液呈中性,则反应后溶液存在的离子有 ,其浓度由大到小的顺序为
,氨水的浓度a 0.01 mol·L-1(填“>”、“<”或“=”)。
(7)在25℃下,向浓度均为0.20 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀(填化学式),生成该沉淀的离子方程式为 ;当测得溶液pH=11时,则此温度下残留在溶液中的c(Mg2+):c(Cu2+)= (已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.0×10-20)
在水溶液中橙红色的Cr2O72-与黄色的CrO42-有下列平衡关系.
Cr2O72-+H2O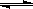 2CrO42-+2H+,把K2Cr2O7溶于水配成稀溶液是橙色。
2CrO42-+2H+,把K2Cr2O7溶于水配成稀溶液是橙色。
(1)向上述溶液中加入NaOH溶液,溶液呈色,因为。
(2)向已加入NaOH溶液的(1)中再加入过量稀H2SO4,则溶液呈色,
因为。
(3)向原溶液中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀)则平衡,溶液颜色将。
(1)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0 kJ·mol-1;由N2和H2合成1molNH3时可放出46.2kJ的热量。
根据上述数据可计算:N-H键的键能是。
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8 kJ·mol-1
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g)△H=-47.2 kJ·mol-1
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g)△H=+640.5 kJ·mol-1
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
_________________。
化学能和电能的相互转化,是能量转化的重要方式之一,如图两个实验装置是实现化学能和电能相互转化的装置。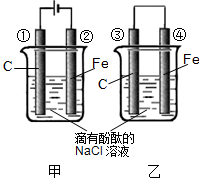
(1)把化学能转化为电能的装置是(填“甲”或“乙”);
(2)④电极上的电极反应式为
(3)①电极上的电极反应式为,
检验该电极反应产物的方法是
(4)写出装置甲的反应总化学方程式。
1.28 g 的铜与足量的浓硝酸充分反应后,可收集到气体mL(标况下)被还原的硝酸的物质的量是。
A、B、C、D四种短周期元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,B与C的单质在加热条件下反应,生成一种淡黄色的固体E;D的L层电子数等于K、M两个电子层上的电子数之和
(1)写元素符号:A为 ,C为 ,D的最高价氧化物的水化物化学式是。
(2)写出A、B形成的化合物与E反应的化学方程式:
(3)E属于(“离子”或“共价”)化合物。
(4)C与D两元素可形成化合物。