有某可逆反应aA(g)+bB(g)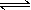 cC(g);△H="Q" kJ/mol如图表示外界条件(温度、压强)的变化对上述反应的影响。下列判断正确的是( )
cC(g);△H="Q" kJ/mol如图表示外界条件(温度、压强)的变化对上述反应的影响。下列判断正确的是( )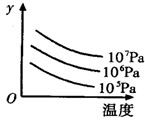
| A.a+b<c时,y轴表示平衡混合气中C的质量分数 |
| B.a+b>c时,y轴表示平衡混合气的平均摩尔质量 |
| C.Q > 0时,y轴表示达到平衡时B的转化率 |
| D.Q < 0时,y轴表示达到平衡时A的浓度 |
27.4g的Na2CO3与NaHCO3的固体混合物,在空气中加热片刻后固体混合物质量变为24g,将所得的固体混合物溶于200ml、2mol•L﹣1的稀盐酸恰好完全反应,并完全放出二氧化碳气体,将所得的溶液蒸干、灼烧称量,其质量为()
| A.11.7g | B.23.4 g | C.26.5g | D.58.5g |
A、B、C、X均为中学化学常见物质,一定条件下有如图所示转化关系(其他产物已略去),下列说法错误的是( )
A.若X为O2,则A可为硫化氢
B.若X为KOH溶液,则A可为AlCl3
C.若X为Cl2,则C可为FeCl3
D.若A、B、C均为焰色反应呈黄色的化合物,则X可为CO2
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图所示),下列有关说法正确的是()
| A.洗气瓶中产生的沉淀是碳酸钡 |
| B.从Z导管出来的气体中无二氧化碳 |
| C.洗气瓶中产生的沉淀是亚硫酸钡 |
| D.在Z导管口有红棕色气体出现 |
下列两种物质发生反应
①Na和O2 ②AlCl3与氨水 ③水玻璃与CO2 ④Fe与Cl2 ⑤Fe和稀HNO3,因反应物用量或反应条件的不同而生成不同产物的是()
| A.①②③④⑤ | B.①②③⑤ | C.①②⑤ | D.①③⑤ |
已知氨气极易溶于水,而难溶于有机溶剂CCl4.下列装置中不适宜做氨气的尾气吸收装置的
A.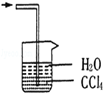 |
B.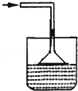 |
C. |
D.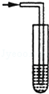 |