利用如图所示装置收集以下8种气体(图中烧瓶的位置不得变化)
①H2 ②Cl2 ③CH4 ④HCl ⑤NH3 ⑥NO ⑦H2S ⑧SO2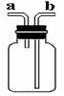
(1)若烧瓶是干燥的,则由b口进气收集的气体有 (写序号);
(2)若烧瓶充满水,可收集的气体有 (写序号)。
(3)若在烧瓶内装入浓硫酸使气体干燥,则可用此装置来干燥的气体有________,这时气体由________口进入。
铝是一种重要的金属,在生产、生活中具有许多重要的用途,下图是从铝土矿中制备铝的工艺流程:
已知:①铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
②溶液中的硅酸钠与四羟基合铝酸钠反应,能生成硅铝酸盐沉淀,化学反应方程式为:
2Na2SiO3+2Na[Al(OH)4]===Na2Al2Si2O8↓+4NaOH+2H2O
回答下列问题:
(1)写出铝土矿中Al2O3与氢氧化钠溶液反应的化学方程式。
(2)过滤操作用到的玻璃仪器除了烧杯外,还有。
(3)滤渣A的主要成分为;滤渣A的用途是(写一种)。
(4)在流程第三步“酸化”中,加入的最佳物质A是___________。理由是_______ ________。
(5)将a g镁铝合金投入100mL、1mol/L的盐酸中,金属完全溶解,再加入200mL、1mol/L NaOH溶液,沉淀恰好达到最大值,质量为(a+1.7)g,镁铝合金与盐酸反应时转移的电子数为。
A~G各物质间的关系如图,其中B、D为气态单质。
请回答下列问题:
(1)物质C、E分别为、。(填名称)
(2)反应①可选用不同的A进行,若反应在常温下进行,其化学方程式为。
(3)反应②的离子方程式为。
(4)新配制的F溶液应加入________以防止其转化为G。请设计实验检验F、G的混合溶液中F的金属阳离子。(写出试剂、操作、现象、结论)。
已知X,Y,Z,W四种短周期元素的原子序数依次增大,其中X与Y、Z、W所形成的常见化合物(10e或18e)在常温下均为气态,在元素周期表中Z与W相邻,Y的最高价氧化物的水化物与其氢化物反应生成盐,且Y的核电荷数与W的最外层电子数相同。
(1)Z离子的结构示意图是。
(2)X、Y、W可组成一种化合物,原子个数比为4:1:1,该化合物的化学式是,其中含有的化学键有 。
(3)X与Y所形成的分子的电子式为,它比同主族其他元素的氢化物沸点高的原因是。
(4)请设计一个简单的实验,说明Z、W两种元素非金属性的强弱,写出实验方法和现象: ___。
(14分)下图表示有关的一种反应物或生成物(无关物质已略去),其中A、C为无色气体,请填写下列空白。
(1)化合物W可能是____________或__________,C是____________,F是____________。
(2)反应①中若消耗Na2O2 7.8 g,则转移的电子数为______________________。
(3)反应③的离子方程式:__________________________________________。
(4)A与CuO在加热条件下能反应生成N2和Cu,请写出该反应的化学方程式:
_____________________________________________________________________。
完成下列化学方程式或离子方程式。
①.过氧化钠与二氧化碳反应化学方程式:
②.铝和NaOH溶液反应化学方程式:
③.氢氧化铝和NaOH溶液反应离子方程式:
④.硫酸亚铁与氢氧化钠溶液离子方程式:
⑤.FeCl3和Cu反应离子方程式: