某研究性学习小组做了以下实验:向溴水中加入足量乙醛溶液,观察到溴水褪色的现象。
(1)[提出问题]
产生上述现象的原因是什么?
(2)[提出猜想]
①溴水与乙醛发生取代反应。
②___________________________________________________。
③___________________________________________________。
(3)[设计方案]
方案一:检验褪色后溶液的酸碱性。
方案二:测定反应前溴水中Br2的物质的量和反应后Br-离子的物质的量。
(4)[实验探究]
取含0.005mol Br2的溶液10mL,加入足量乙醛溶液使其褪色,再加入过量AgNO3溶液,过滤、洗涤、干燥后称重固体质量为1.88g。
(5)[解释与结论]
假设测得反应前溴水中Br2的物质的量为a mol,
若测得反应后n(Br-)=0 mol,则说明溴水与乙醛发生了____________反应。
若测得反应后n(Br-)=a mol,则说明溴水与乙醛发生了____________反应。
若测得反应后n(Br-)=2a mol,则说明溴水与乙醛发生了____________反应。
若已知CH3COOAg易溶解于水,试通过计算判断溴水与乙醛发生反应的类型为___________。理由是________________________________________。
其反应的离子方程式为__________________________________________________。
(6)[反思与评价]
方案一是否可行?__________。理由是_______________________________。
有文献记载:在强碱条件下,加热银氨溶液可能析出银镜。某同学进行如下验证和对比实验。
| 装置 |
实验序号 |
试管中的药品 |
现象 |
 |
实验Ⅰ |
2
银氨溶液和数 滴较浓 溶液 |
有气泡产生: 一段时间后,溶液 逐渐变黑:试管壁 附着银镜 |
| 实验Ⅱ |
2
银氮溶液和 数滴浓氨水 |
有气泡产生: 一段时间后,溶液 无明显变化 |
该同学欲分析实验Ⅰ和实验Ⅱ的差异,查阅资料:
a.
b. 不稳定,极易分解为黑色
(I)配制银氨溶液所需的药品是。
(2)经检验,实验Ⅰ的气体中有
,黑色物质中有
.
①用湿润的红色石蕊试纸检验
,产生的现象是。
②产生
的原因是。
(3)该同学对产生银镜的原因提出假设:可能是
还原
。实验及现象:向
溶液中加入,出现黑色沉淀;水浴加热,未出现银镜。
(4)重新假设:在
存在下.可能是
,还原
。用右图所示装置进行实验。现象:出现银镜。在虚线框内画出用生石灰和浓氨水制取
的装置简图(夹持仪器略)。
(5)该同学认为在(4)的实验中会有
生成。由此又提出假设:在
存在下,可能是
也参与了
还原
的反应.进行如下实验:
①有部分
溶解在氨水中,该反应的化学方程式是。
②实验结果证实假设成立,依据的现象是。
(6)用 消洗试管壁上的 ,该反应的化学方程式是。
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的酸度(酸度单位:g/100ml),现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定。下表是4种常见指示剂的变色范围:
| 指示剂 |
石蕊 |
甲基橙 |
甲基红 |
酚酞 |
| 变色范围(PH) |
5.0-8.0 |
3.1-4.4 |
4.4-6.2 |
8.2-10.0 |
(1)该实验应选用作指示剂,向锥形瓶中移取一定体积的白醋所用的仪器是。
(2)下图表示50ml滴定管中液面的位置,若A与C刻度间相差1ml,A处的刻度为25,滴定管中液面读数为ml。此时滴定管中液体的体积。
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为Vml,NaOH标准液浓度为C mol/L,三次实验结果记录如下:
| 实验次数 |
第一次 |
第二次 |
第三次 |
| 消耗NaOH溶液体积/ml |
26.02 |
25.32 |
25.28 |
从上表可以看出,第一次实验中记录消耗NaOH溶液体积明显多于后两次,其原因可能
是
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
E.滴定NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)根据所给数据,写出计算该白醋中总酸度的表达式(可以不必化简):
(酸度:每100ml溶液中含有溶质酸的质量,单位:g/100ml)
某校化学小组的同学开展了一系列的化学实验活动。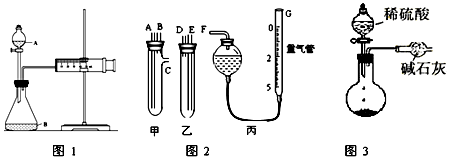
(1)甲同学用图1所示装置,测量锌与硫酸反应速率:把2g锌粒放入锥形瓶内,通过分液漏斗加入1mol·L-1稀硫酸40mL,收集10mL气体,通过记录得到反应速率为XmolL-1·min-1。实验开始时检查该装置气密性的方法是。
(2)乙同学用图2装置测定Na2CO3和NaCl的固体混合物中Na2CO3的质量分数:
①甲、乙两试管各有两根导管,用橡胶管连接对应接口后,倒置盛稀硫酸的试管,发生反应,放出气体,则Na2CO3、NaCl的固体混合物和稀硫酸应分别置于、仪器中(填仪器编号);
②G管可以用化学实验室里的一种常用仪器来替代,这种仪器的名称是;
③仪器甲、乙接口的连接方式如下:A连接,B连接,C连接
(填写各接口的编号)。
④为提高测量的准确性,收集完气体后,丙装置读数前应进行的操作是____________。如果开始读数时操作正确,最后读数时俯视右边滴定管液面,会导致所测气体的体积__________(填“偏大”、“偏小”或“无影响”)。
(3)丙同学与甲同学实验目的相同:用图3装置测定生成的CO2的质量,但该装置存在明显缺陷,从而导致实验误差,请你分析其中使测定结果可能偏大的主要原因。
(每空2分,共18分)
(一)实验室用下图装置制取少量溴苯,试填写下列空白。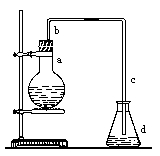
(1)在烧瓶a中装的试剂是。
(2)长直导管b的作用:。
(3)请你分析导管c的下口可否浸没于液面中?(填“可”或 “否”)
(4)反应完毕后,向锥形瓶d中滴加AgNO3溶液,有关反应的离子方程式:。
(二)某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛,图中铁架台等装置已略去,粗黑线表示乳胶管。请填写下列空白: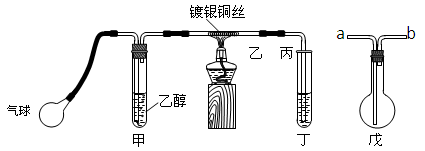
(1)甲装置常常浸在70~80℃的水浴中,目的是
(2)实验时,先加热玻璃管乙中的镀银铜丝,约1分钟后鼓入空气,此时铜丝即呈红热状态。若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束。
乙醇的催化氧化反应是________反应(填“放热”或“吸热”),
该反应的化学方程式为。
(3)若试管丁中用水吸收产物,则要在导管乙、丙之间接上戊装置,其连接方法是
(填戊装置中导管代号):乙接、_______接丙;
若产物不用水吸收而是直接冷却,应将试管丁浸在 _____中。
(共10分)化学上常用燃烧法确定有机物的组成.这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成.下图所列装置是用燃烧法确定有机物分子式常用的装置.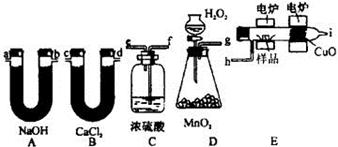
回答下列问题:
(1)产生的氧气按从左到右流向,所选装置各导管的连接序号(填写接口代号)是:
________________________________________;
(2)C装置中浓H2SO4的作用是________________________________;
(3)D装置中MnO2的作用是__________________________________;
(4)燃烧管中CuO的作用是___________________________________;
(5)若准确称取 0.90 g样品(只含 C、H、O三种元素中的两种或三种),经充分燃烧后,
A管质量增加1.32 g,B管质量增加0.54 g,则该有机物所含元素的最简比为___________。