有关化学平衡常数(K)的说法中不正确的是( )
| A.K值越大,正反应进行的程度越大 |
| B.一般地说,K>105时,该反应进行得就基本完全了 |
| C.压强越大,K值越大 |
| D.K与反应物或生成物的浓度变化无关 |
2010年3月22日是第十八届“世界水日”,3月22~28日是第二十三届“中国水周”。经研究确定,2010年我国纪念“世界水日”和开展“中国水周”活动的宣传主题为“严格水资源管理,保障可持续发展”。下列有关活动不符合这一主题的是( )。
| A.大力提倡全民节约用水,加强城市生活污水处理,坚持达标排放 |
| B.大力推广使用纯净水代替自来水作生活用水,以保障用水安全 |
| C.加快产业结构调整,建立水资源节约型、环保型的国民经济体系 |
| D.加强工业用水净化系统工程的改造,提高水的重复利用率 |
2010年上海世博会的主题是“城市,让生活更美好”。下列叙述中不正确的是( )。
| A.世博会前期,处理废水时加入明矾可作为混凝剂以吸附水中的杂质 |
| B.反复煮沸的水不能饮用 |
| C.可以用氯气对生活用水进行消毒 |
| D.游览世博园时,多饮用纯净水对身体有益 |
下列说法正确的是
| A.不管什么反应使用催化剂,都可以加快反应速率 |
B.可逆反应A(g) B(g)+C(g),增大压强正反应速率减小,逆反应速率增大 B(g)+C(g),增大压强正反应速率减小,逆反应速率增大 |
| C.对达到平衡的一个放热的可逆反应,若降低温度正反应速率减小,逆反应速率增大 |
| D.参加反应物质的性质是决定化学反应速率的主要因素 |
下表是元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是
| A.常压下五种元素的单质中Z单质的沸点最高 |
| B.Y、Z的阴离子电子层结构都与R原子的相同 |
| C.W的氢化物还原性小于Y的氢化物 |
| D.Y元素的非金属性比W元素的非金属性强 |
如图所示的装置中铁棒上析出铜,而铁的质量不变,符合要求的原电池是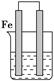
| A.铁棒作负极,铜棒作正极,电解质溶液是CuSO4溶液 |
| B.镁棒作负极,铁棒作正极,电解质溶液是CuSO4溶液 |
| C.镁棒作负极,铁棒作正极,电解质溶液是FeCl3溶液 |
| D.铁棒作负极,铜棒作正极,电解质溶液是H2SO4溶液 |