反应2SO2+O2 2SO3,在一段时间后c(SO3)增加了0.40mol·L-1 ,在这段时间内用O2表示的反应速率为0.040mol·L-1·s-1 ,则这段时间为( )
2SO3,在一段时间后c(SO3)增加了0.40mol·L-1 ,在这段时间内用O2表示的反应速率为0.040mol·L-1·s-1 ,则这段时间为( )
| A.0.10s | B.2.5s | C.5.0s | D.10s |
由14CO和12CO组成的混合气体与同温同压下空气的密度相等(空气的平均相对分子质量为29),则下列关系正确的是
| A.混合气体中,12CO占有的体积等于14CO占有的体积 |
| B.混合气体中,12CO与14CO分子个数之比为1∶2 |
| C.混合气体中,12CO与14CO质量之比为15∶14 |
| D.混合气体中,12CO与14CO密度之比为14∶15 |
下列指定反应的离子方程式正确的是
| A.Cu溶于稀HNO3:Cu+ 2H++ NO3-=Cu2+ + NO2↑+ H2O |
| B.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2+ + 2OH-=Fe(OH)2↓ |
| C.用CH3COOH溶解CaCO3:CaCO3 + 2H+=Ca2+ + H2O+ CO2↑ |
| D.向NaAlO2溶液中通过量CO2制Al(OH)3:CO2+ AlO2-+ 2H2O =Al(OH)3↓+ HCO3- |
常温下,下列各组离子在指定溶液中能大量共存的是
| A.滴入KSCN显红色的溶液:Na+、Cu2+、Br-、SO42- |
| B.滴入酚酞显红色的溶液:Na+、Al3+、SO42-、Cl- |
| C.c(Fe2+)=1 mol·L-1的溶液:H+、Na+、Cl-、NO3- |
| D.加入铝粉能产生大量H2的溶液:Na+、K+、Cl-、HCO3- |
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA |
| B.室温下,1 L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA |
| C.氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA |
D.5NH4NO3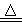 2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA 2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA |
下图是某同学用500 mL容量瓶配制0.10 mol·L-1 NaOH溶液的过程:
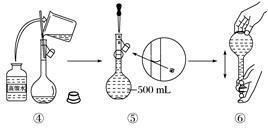
该同学的错误步骤有
| A.1处 | B.2处 | C.3处 | D.4处 |