下列分子中,杂化类型相同,空间构型也相同的是( )
| A.H2O、SO2 | B.BeCl2、CO2 | C.H2O、NH3 | D.NH3、CH2O |
已知某酸H2B在水溶液中存在下列关系:①H2B H++HB-,②HB-
H++HB-,②HB- H++B2-。关于该酸对应的酸式盐NaHB的溶液,下列说法中一定正确的是
H++B2-。关于该酸对应的酸式盐NaHB的溶液,下列说法中一定正确的是
A.NaHB属于弱电解质
B.溶液中的离子浓度c(Na+)>c(HB-)>c(H+)>c(OH-)
C.NaHB和NaOH溶液反应的离子方程式为H++OH-===H2O
D.c(Na+)=c(HB-)+c(B2-)+c(H2B)
在容积一定的密闭容器中,反应2A 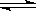 B(g)+C(g)达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是
B(g)+C(g)达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是
| A.正反应是吸热反应,且A是气态 |
| B.正反应是放热反应,且A不是气态 |
| C.其他条件不变,加入少量A,该平衡不移动 |
| D.改变压强对该平衡的移动无影响 |
pH相等的盐酸(甲)和醋酸(乙),分别与锌反应,若最后锌已全部溶解且放出气体一样多,为此下列说法正确的是
| A.反应结束后溶液的pH:甲>乙 | B.反应开始时的速率:甲>乙 |
| C.反应所需时间:甲<乙 | D.反应开始时,酸的物质的量浓度:甲>乙 |
二甲醚是一种绿色、可再生的新能源。下图是绿色电源“二甲醚燃料电池”的工作原理示意图(a、b均为多孔性Pt电极)。该电池工作时,下列说法不正确的是
| A.a电极为该电池负极 |
| B.电池工作时,燃料电池内部H+从a电极移向b电极 |
| C.电池工作时,a电极反应式:CH3OCH3—12e-+3H2O═ 2CO2↑+12H+ |
| D.O2在b电极上得电子,电极反应式:O2+4e-+2H2O═ 4OH- |
某温度下,某反应达到平衡,平衡常数k=C(CO2).C(H2)/ C(CO).C(H2O)。恒容时,升高温度,CO浓度增大。下列说法正确的是
| A.升高温度,逆反应速率增大,正反应速率减小 |
| B.恒温时,增大压强,CO浓度不变 |
C.该反应的化学方程式为:CO2+H2 CO+H2O CO+H2O |
| D.该反应的焓变为负值 |