向盛有硫酸铜水溶液的试管里滴加氨水,首先形成难溶物;继续滴加氨水,难溶物溶解,得到深蓝色的透明溶液。下列对此现象说法正确的是
| A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 |
| B.沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4] 2+ |
| C.向反应后的溶液加入乙醇,溶液将没有明显现象,因为[Cu(NH3)4] 2+不与乙醇反应 |
| D.在[Cu(NH3)4] 2+离子中,Cu2+给出孤电子对,NH3提供空轨道 |
下图是各种不同密度的硝酸与铁反应(相同温度)时主要还原产物的分布图。请认真读图分析,回答有关问题。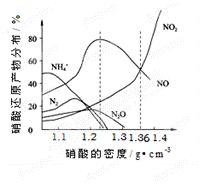
⑴下列叙述中正确的是(填序号)。
A.图中横坐标是硝酸的密度,硝酸的密度越大,其浓度越大
B.当还原剂和温度相同时,不同浓度的硝酸被还原的产物不是单一的,只是在某浓度时,以某种产物为主而已
C.硝酸的浓度越大,还原产物中N元素低化合价产物越多
D.当硝酸密度大于1.3 g·cm-3时,还原产物主要为NO、NO2
⑵当硝酸溶液的密度为1.36 g·cm-3时,下列化学方程式中,能较准确表达Fe与过量硝酸反应的是(填序号)。
A.2Fe + 10HNO3 ="=" 2Fe(NO3)3 + NO↑+3NO2↑+5H2O
B.4Fe + 18HNO3 ="=" 4Fe( NO3)3 + 3NO↑+3NO2↑+9H2O
NO3)3 + 3NO↑+3NO2↑+9H2O
C.3Fe + 12HNO3 ="=" 2Fe(NO3)3 + Fe(NO3)2 + 2NO↑+2NO2↑+3H2O
⑶密度为1.26 g·cm-3,质量分数为50.0 %的硝酸,其物质的量浓度是mol·L-1。
⑷限用下列仪器、药品验证由铁和过量1.36 g·cm-3硝酸反应产生的气体中含有NO(不考虑N2O4)。设计一个合理而简单的实验方案(仪器可选择使用,N2的用量可自由控制,加热装置和固定装置省略)。
第1步:反应并收集生成的气体:
①实验中气体发生装置应选择哪种装置及理由是。
②装置的连接顺序是(填各装置接口的序号):[ ]→[ ] [ ]→[8] [9]→[ ]。
③检查装置气密性后,开始反应。待E中充满红棕色气体,停止实验。
第2步:验证E中有NO。
④取下试管E,倒立在F中,轻轻摇动试管。
确认生成的气体中有NO的现象是。
某CuSO4、Fe2(SO4)3、H2SO4的混合溶液100 mL,已知溶液中阳离子的浓度相同(不考虑水解),且SO的物质的量浓度为6 mol·L-1,则此溶液最多溶解铁粉的质量为
| A.5.6 g | B.11.2 g | C.22.4 g | D.33.6 g |
对于可逆反应N2(g)+3H2(g) 2NH3(g);△H
2NH3(g);△H <0,下列研究目的和示意图相符的是
<0,下列研究目的和示意图相符的是
| A |
B |
C |
D |
|
| 研究目的 |
压强对反应的影响(P2﹤P1) |
温度对反应的影响 |
增加N2对反应的影响 |
催化剂对反应的影响 |
| 图示 |
 |
 |
 |
 |
下列图像表示Al3+与AlO2-物质的量变化的曲线,实线表示Al3+,虚线表示AlO 2-,其中正确的是
2-,其中正确的是
自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS)。下列分析正确的是
| A.CuS的溶解度大于PbS的溶解度 |
| B.原生铜的硫化物具有还原性,而铜蓝没有还原性 |
C.CuSO4与Z nS反应的离子方程式是Cu2++S2-===CuS↓ nS反应的离子方程式是Cu2++S2-===CuS↓ |
| D.整个过程涉及的反应类型有氧化还原反应和复分解反应 |