已知金属离子从开始形成氢氧化物沉淀到沉淀完全时溶液的pH。
(1)实验室配制FeCl2溶液时需加入少许盐酸和铁粉,若只加盐酸、不加铁粉,溶液中会发生什么变化,用离子方程式表示为: ;
(2)氯化铜晶体(CuCl2·2H2O)中含FeCl2杂质,为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下面所示的操作步骤进行提纯。
①加氧化剂X的目的是 ,下列氧化剂中最适合作氧化剂X的是 (填序号);
| A.NaClO | B.H2O2 | C.KMnO4 | D.HNO3 |
②物质Y的化学式是 ;加入物质Y的目的是调节溶液的pH至a,使Fe3+沉淀完全,则a的范围是 ;若25℃时,a=3的溶液中,c(Fe3+)= mol·L-1。(25℃时,Ksp[Fe(OH)3]=4.0×10-38)
(3)欲将CuCl2·2H2O加热制得无水CuCl2,将采用什么方法和措施?__________。
碳和氮的化合物与人类生产、 生活密切相关。
(1)在一恒温、恒容密闭容器中发生反应:
利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。下列说法正确的是(填字母编号)。
| A.增加Ni的量可提高CO的转化率, Ni的转化率降低 |
| B.缩小容器容积, 平衡右移,ΔH减小 |
| C.反应达到平衡后, 充入CO再次达到平衡时, CO的体积分数降低 |
| D.当4v正[Ni(CO) 4]= v正(CO) 时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态 |
(2)CO与镍反应会造成含镍催化剂的中毒。为防止镍催化剂中毒, 工业上常用SO2将CO氧化, 二氧化硫转化为单质硫。
(3)对于反应: ,向某容器中充入10mol的NO和10mol的O2,在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下随温度变化的曲线(如图)。
,向某容器中充入10mol的NO和10mol的O2,在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下随温度变化的曲线(如图)。
①比较P1、P2的大小关系: ________________。
②700℃时,在压强为P2时, 假设容器为1L,则在该条件平衡常数的数值为_____ (最简分数形式)
(4)NO2、 O2和熔融NaNO3可制作燃料电池, 其原理如图所示。该电池在使用过程中石墨Ⅰ电极上生成氧化物Y, 其电极反应式为。若该燃料电池使用一段时间后, 共收集到20mol Y, 则理论上需要消耗标准状况下氧气的体积为L。
【化学——选修3:物质结构与性质】(15分)稀土元素是指元素周期表中原子序数为57到71的15种镧系元素,以及与镧系元素化学性质相似的钪(Sc)和钇(Y)共17 种元素。稀土有“工业维生素”的美称,如今已成为极其重要的战略资源。
(1)钪(Sc)为21号元素,其基态原子M能层电子数为。镝(Dy)的基态原子电子排布式为[Xe]4f106s2,一个基态镝原子所含的未成对电子数为。
(2)稀土元素最常见的化合价为+3价,但也有少数还有+4价。请根据下表中的电离能数据判断表中最有可能有+4价的元素是。
几种稀土元素的电离能(单位:kJ·mol-1)
| 元素 |
I1 |
I2 |
I3 |
I1+I2+I3 |
I4 |
| Sc(钪) |
633 |
1235 |
2389 |
4257 |
7019 |
| Y(钇) |
616 |
1181 |
1980 |
3777 |
5963 |
| La(镧) |
538 |
1067 |
1850 |
3455 |
4819 |
| Ce(铈) |
527 |
1047 |
1949 |
3523 |
3547 |
(3)离子化合物 Na3[Sc(OH)6]中,存在的作用力除离子键外还有。
(4)Sm(钐)的单质与1,2-二碘乙烷可发生如下反应:Sm+ICH2CH2I→SmI2+CH2=CH2。
ICH2CH2I中碳原子杂化轨道类型为,1 mol CH2=CH2中含有的σ键数目为。常温下1,2-二碘乙烷为液体而乙烷为气体,其主要原因是。
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中Pr(镨)原子位于面心和顶点。则PrO2(二氧化镨)的晶胞中有个氧原子。
(6)Ce(铈)单质为面心立方晶体,其胞参数为a=516pm。晶胞中Ce(铈)原子的配位数为,列式表示Ce(铈)单质的密度:g·cm-3(不必计算出结果)。
(12分)甲醇可作为燃料电池的原料。通过下列反应可以制备甲醇:CO ( g )+2H2 ( g )  CH3OH ( g )
CH3OH ( g )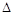 H=-90.8 kJ·mol-1,在一容积可变的密闭容器中充入10 mol CO 和20 mol H2,CO 的 平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态B 时,容器的体积为4 L。
H=-90.8 kJ·mol-1,在一容积可变的密闭容器中充入10 mol CO 和20 mol H2,CO 的 平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态B 时,容器的体积为4 L。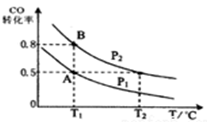
(1)该反应的化学平衡常数表达式为。
(2)如反应开始时仍充入10 mol CO 和20 mol H2,则在平衡状态A时,容器的体积V(A)=L。
(3)关于反应CO(g)+2H2(g) CH3OH(g)建立化学平衡状态时的标志是(填字母)。
CH3OH(g)建立化学平衡状态时的标志是(填字母)。
A.CO的含量保持不变
B.容器中CH3OH浓度与CO浓度相等
C.2V正(CH3OH)=V正(H2)
D.容器中混合气体的平均相对分子质量保持不变
(4)已知CO2(g)+H2(g) CO(g)+H2O(g) H=+41.3 kJ·mol-1,试写出由CO2和H2制取甲醇的热化学方程式。
CO(g)+H2O(g) H=+41.3 kJ·mol-1,试写出由CO2和H2制取甲醇的热化学方程式。
(5)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。
实验室用下图装置模拟上述过程: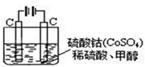
①写出阳极的电极反应式_______________。
②写出除去甲醇的离子方程式__________________。
(14分)下表为元素周期表的一部分,请参照元素①-⑩在表中的位置,用化学用语回答下列问题: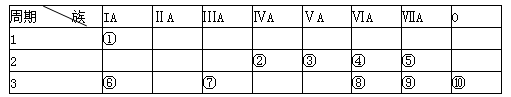
(1)非金属性最强的是(填元素符号)、化学性质最不活泼的是______(填元素符号)。
(2)由①、④、⑥、⑨中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
(3)②、③、⑨的最高价含氧酸的酸性由强到弱的顺序是_____________(填化学式)。
(4)表中能形成两性氢氧化物的元素是(填元素符号),分别写出该元素的氢氧化物与⑥、⑧最高价氧化物的水化物反应的离子方程式:,。
(5)请设计一个实验方案,比较④、⑧单质氧化性的强弱,并描述现象和结论:__
(12分)【选做题】本题包括A、B两小题,请选定其中一小题,并在相应的答题区域内作答。若多做,则按A小题评分。
A.[物质结构与性质]钛的化合物如TiSe2、Ti(NO3)4、TiCl4、酒石酸钛等均有着广泛用途。
(1)写出Se的基态原子的外围电子排布式。
(2)酒石酸钛配合物广泛应用于药物合成。酒石酸(结构如图所示) 中羧基氧原子的轨道杂化类型分别是,1 mol酒石酸中π键的数目是。
中羧基氧原子的轨道杂化类型分别是,1 mol酒石酸中π键的数目是。
(3)TiCl4熔点是—25℃,沸点136.4℃,可溶于苯或CCl4,该晶体属于晶体;NO3—离子的空间构型为。
(4)主族元素A和钛同周期,具有相同的最外层电子数,元素B原子的p能级所含电子总数与s能级所含电子总数相等,且其形成的氢化物分子之间存在氢键。元素A、元素B和钛三者形成的晶体的晶胞如图所示,写出该晶体的化学式(用元素符号表示)。