下列四个实验中,结论正确的是( )
| A.有一澄清的碱性溶液,做离子鉴定时得出的结论是含有:Al(OH) 4-、Fe3+、HCO3- |
| B.某一固体溶于水后,检验出含有K+、NO3-、Na+、Cl-等离子,则该固体混合物是KNO3和NaCl的混合物或KCl和NaNO3的混合物 |
| C.固体NaOH吸收了空气中的二氧化碳并溶于水后,则溶液中就一定大量存在碳酸根离子 |
| D.加热碳酸氢铵固体,将生成的气体通过碱石灰能制备NH3 |
天然维生素P结构如图, 关于维生素P的叙述错误的是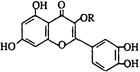
| A.可以和浓溴水反应 |
| B.可和氢气发生加成反应 |
| C.分子中有7个C=" C" 键 |
| D.1mol维生素P可以和4molNa2CO3反应 |
常温下,下列有关叙述正确的是
| A.Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| B.NaB溶液的pH=8,c(Na+)-c(B-)=0.99×10-6mol/L |
| C.pH相等的①NH4Cl、②(NH4)2SO4、③NH4HSO4三种溶液中,c(NH4+)大小顺序①=②>③ |
| D.10mL pH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积V(总)≥20mL |
日前朝鲜一辆载有硝酸铵的列车与另一辆列车相撞导致电线短路继而引发剧烈爆炸,造成重大人员伤亡。硝酸铵受撞击或高温发生爆炸的反应为:a NH4NO3→b O2+c N2+d H2O,下列关于方程式中化学计量数的说法正确的是
| A.a=1 | B.b= 2 2 |
C.c=3 | D.d=4 |
据报道,科学家己经研制出世界上最薄的材料一碳膜片,其厚度只有一根头发的二十万分之一。如图所示,这种碳膜片状如蜂巢,是由碳原子构成的六边形单元向外延展而成,下列有关碳膜片的说法中,正确的是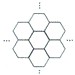
| A.碳膜片属于单质 |
| B.碳膜片与C60是同一种元素形成的不同单质 |
| C.碳膜片属于新型的金属材料 |
| D.碳膜片在氧气中完全燃烧的产物和碳在氧气中完全燃烧的产物不同 |
下列实验设计能够成功的是()
| 实验目的 |
实验步骤及现象 |
|
| A |
检验亚硫酸钠试样是否变质 |
 |
| B |
检验某卤代烃是否是氯代烃 |
 |
| C |
证明酸性条件下H2O2氧化性比I2强 |
 |
| D |
除去氯化钠溶液中的少量硫酸钠 |
 |