氧化还原反应的实质是
| A.氧元素参加反应 | B.元素化合价变化 |
| C.电子的转移(得失或偏移) | D.原子重新组合 |
对于反应COCl2(g) CO(g)+Cl2(g)。改变下列条件:①升温 ②恒容下通入惰性气体③增加COCl2浓度 ④减压 ⑤加催化剂 ⑥恒压下通入惰性气体,能加快反应速率的是
CO(g)+Cl2(g)。改变下列条件:①升温 ②恒容下通入惰性气体③增加COCl2浓度 ④减压 ⑤加催化剂 ⑥恒压下通入惰性气体,能加快反应速率的是
| A.①②⑤ | B.①③⑤ | C.②④⑥ | D.③⑤⑥ |
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转
化关系: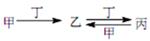 。下列有关物质的推断不正确的是
。下列有关物质的推断不正确的是
| A.若甲为焦炭,则丁可能是 O2 |
| B.若甲为 SO2,则丁可能是氨水 |
| C.若甲为 Fe,则丁可能是盐酸 |
| D.若甲为 NaOH 溶液,则丁可能是 CO2 |
下列做法不利于金属防护的是
| A.菜刀切菜后不洗净就放回刀架 | B.将钢铁制成不锈钢 |
| C.在铁塔的表面喷油漆 | D.埋在地下的钢管与锌块连接 |
下列关于离子的检验方法一定正确的是
| A.向某溶液中滴加BaCl2溶液,有白色沉淀生成,再滴加足量稀HNO3,沉淀不溶解,说明原溶液中一定含有Ag+ |
| B.向某溶液中滴加浓NaOH溶液,加热,产生的气体使湿润的红色石蕊试纸变蓝色,说明原溶液中含NH4+ |
| C.向某溶液中滴加足量稀盐酸,产生使澄清石灰水变浑浊的气体,说明原溶液中一定含CO32- |
| D.用铂丝蘸取某溶液在无色火焰上灼烧,直接观察火焰颜色未见紫色,说明原溶液中不含K+ |
下列说法正确的是
| A.二氧化硫有漂白性,可用于加工食品使食品增白 |
| B.从海水中提取碘常用过氧化氢做还原剂 |
| C.Na2SiO3是制备硅胶和木材防火剂的原料 |
| D.铝热剂就是指铝和氧化铁的混合物 |