现有四种元素的基态原子的核外电子排布式如下:
①1s22s22p63s23p4 ②1s22s22p63s23p3 ③1s22s22p3④1s22s22p5
则下列有关比较中正确的是 ( )
| A.第一电离能:④>③>②>① | B.原子半径:④>③>②>① |
| C.电负性:④>③>②>① | D.最高正化合价:④>③=②>① |
两电极用导线连接插入电解质溶液中(不考虑溶液中溶解的氧气的影响),你认为不能构成原电池的是()
| 选项 |
A |
B |
C |
D |
| 电极材料 |
Zn |
Fe |
Cu |
Al |
| 电极材料 |
Cu |
Zn |
Ag |
C |
| 电解质溶液 |
CuCl2 溶液 |
H2SO4溶液 |
CuSO4 |
NaOH溶液 |
锌、稀硫酸和铜组成的原电池装置中,当导线中有1 mol电子通过时,理论上两极的变化是()
①锌片溶解32.5g;②锌片增重32.5g;
③铜片上析出1g H2;④铜片上析出1mol H2
| A.①和③ | B.①和④ | C.②和③ | D.②和④ |
如图所示的装置中,M为活动性顺序位于氢之前的金属,N为石墨棒。下列关于此装置的叙述中,不正确的是()
| A.N上有气体放出 |
| B.M为负极,N为正极 |
| C.化学能转变为电能的装置 |
| D.导线中有电流通过,电流方向由M到N |
如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是()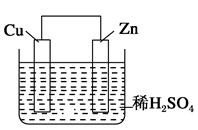
①Zn为正极,Cu为负极;
②H+向负极移动;
③电子是由Zn经外电路流向Cu;
④Cu极上有H2产生;
⑤若有1 mol电子流过导线,则产生的H2为0.5 mol;
⑥正极的电极反应式为Zn-2e-=Zn2+
| A.①②③ | B.③④⑤ | C.④⑤⑥ | D.②③④ |
下列关于锌、铜和稀硫酸构成的原电池的说法中,正确的是()
| A.锌是负极、铜是正极 |
| B.电子从铜片经导线流向锌片 |
| C.负极的反应式为2H++2e-=H2↑ |
| D.反应一段时间后,溶液的pH升高 |