近年来,科学家合成了一系列具有独特化学特性的氢铝化合 物(AlH3)n。已知,最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高。Al2H6球棍模型如下图。下列有关说法肯定错误的是( )
| A.Al2H6在固态时所形成的晶体是分子晶体 |
| B.氢铝化合物可能成为未来的储氢材料和火箭燃料 |
| C.Al2H6中含有离子键和极性共价键 |
| D.Al2H6在空气中完全燃烧,产物为氧化铝和水 |
对下列实验事实的解释正确的是 ()
| A.浓硝酸在光照条件下变黄,说明浓硝酸不稳定生成有色产物能溶于浓硝酸 |
| B.在KI淀粉溶液中通入氯气,溶液变蓝,说明氯气能与淀粉发生显色反应 |
C.在某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成,说明含SO42— |
| D.将铜片放入浓硫酸中,无明显实验现象,说明铜在冷的浓硫酸中发生钝化 |
下列有关说法中正确的是()
| A.双氧水被称为绿色氧化剂,是因为其还原产物为O2,对环境没有污染 |
| B.王水是浓盐酸和浓硝酸按体积比1:3配成的混合物,可以溶解Au、Pt |
| C.氨水能导电,说明氨气是电解质 |
| D.新制备的氯水中存在三种分子,四种离子 |
将标准状况下的a升氯化氢气体溶于1000克水中,得到的盐酸的密度为b克/毫升,则该盐酸的物质的量的浓度是
A.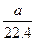 mol·L-1 mol·L-1 |
B.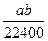 mol·L-1 mol·L-1 |
C.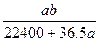 mol·L-1 mol·L-1 |
D.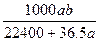 mol·L-1 mol·L-1 |
在给定条件下,下列加点的物质在化学反应中完全消耗的是
| A.标准状况下,将1g铝片投入20mL 18.4mol/L的硫酸中 |
| B.常温下,向100mL 3mol/L的硝酸中加入6.4g铜 |
| C.在适当温度和催化剂作用下,用2molSO2和1molO2合成SO3 |
| D.将含有少量H2O(g)的H2通入盛有足量Na2O2容器中并不断用电火花点燃 |
石棉是一类价格低廉的硅酸盐材料,但是有毒,能使人患肺癌。一种叫矿青石棉的化学式为:Na2Fe5Si8O22(OH)2。它用稀硝酸溶液处理时,还原产物只有NO,下列说法正确的是:
| A.该物质中Fe元素的化合价一定为+2价,且它属于硅酸盐 |
| B.该物质的化学组成可表示为:Na2O·3FeO·Fe2O3·8SiO2·H2O |
| C.1mol该物质能和18molHNO3反应,也能与18mol盐酸反应 |
| D.这种石棉属于新型无机非金属材料 |