硝酸工业的基础是氨的催化氧化,在催化剂作用下发生如下反应:
① 4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H = —905 kJ/mol ①主反应
4NO(g)+6H2O(g) △H = —905 kJ/mol ①主反应
② 4NH3(g)+3O2(g) 2N2(g)+6H2O(g) △H = —1268 kJ/mol ②副反应
2N2(g)+6H2O(g) △H = —1268 kJ/mol ②副反应
有关物质产率与温度的关系如甲图。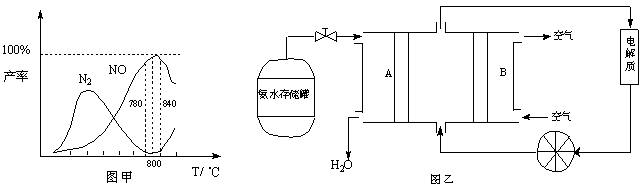
(1)由反应①②可知反应③N2(g) + O2(g) 2NO(g)的反应热ΔH= 。
2NO(g)的反应热ΔH= 。
(2)由图甲可知工业上氨催化氧化生成 NO时,反应温度最好控制在 。
(3)用Fe3O4制备Fe(NO3)3溶液时,需加过量的稀硝酸,原因一:将Fe4O3中的Fe2+全部转化为Fe3+,
原因二: (用文字和离子方程式说明)。
(4)将NH3通入NaClO溶液中,可生成N2H4,则反应的离子方程式为 。
(5)依据反应②可以设计成直接供氨式碱性燃料电池(如乙图所示),则图中A为 (填“正极”或“负极”),电极方程式为 。
近年来,碳和碳的化合物在生产生活实际中应用越来越广泛。
(1)CO和H2的混合气体俗称合成气,是一种重要的工业原料气,焦炭、天然气(主要成分为CH4)、重油、煤在高温下均可与水蒸气反应制得合成气。已知某反应的平衡常数表达式为:K= ,它所对应的化学方程式为: 。
,它所对应的化学方程式为: 。
(2)甲醇是一种重要的化工原料,在日常生活中有着广泛的应用。工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
反应Ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
在以上制备甲醇的两个反应中:反应Ⅰ优于反应Ⅱ,原因为_________________。
(3)在Cu2O/ZnO做催化剂的条件下,将1molCO(g)和2molH2(g)充入容积为2L的密闭容器中合成CH3OH(g),反应过程中,CH3OH的物质的量(n)与时间(t)及温度的关系如下图所示。
根据题意回答下列问题:
①正方应是______反应(填“放热”或“吸热”);500℃时平衡常数K= 。
②在300℃,从反应开始到平衡,氢气的平均反应速率v(H2)= 。
③若其它条件不变,对处于Z点的体系,将体积压缩至原来的1/2,达到新的平衡后,下列有关该体系的说法正确的是 。
a.氢气的浓度与原平衡比减少 b.正、逆反应速率都加快
c.甲醇的物质的量增加 d.重新平衡时n(H2) /n(CH3OH)增大
④据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量的CO2有利于维持Cu2O的量不变,原因是: (写出相关的化学方程式并辅以必要的文字说明)。
(3)甲烷是一种清洁能源,也可用于燃料电池。某甲烷燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料做电极。为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见下图)。A物质的化学式是_________;该原电池的负极反应式可表示为 。
短周期元素A、B、C在周期表中所处的位置如表所示。A、B、C三种元素原子的质子数之和为37,回答下列问题: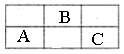
(1)与A元素同周期且金属性最强的元素原子的结构示意图为 。实验室可用无水乙醇处理少量残留的该金属单质,化学方程式为________________,该反应的基本反应类型是_________。
(2)列举一个事实说明C非金属性强于A: ______________(用化学方程式表示)。要清洗附着在试管壁是的C单质,可选用的试剂是___________。
(3)已知:①C(s)+O2(g)=CO2(g)△H=akJ·mol-1;②CO2(g) +C(s)=2CO(g) △H=b kJ· mol-1;③A(s)+ O2(g)=AO2(s)△H=ckJ·mol-1。工业上生产A的热化学方程式为____________(用相应的符号表示,下同)。
(4)NaBO2是B元素形成的一种含氧酸盐,某同学把新制的氯水加到NaBO2溶液中,观察到氯水褪色,同时生成B的另一种含氧酸盐NaBO3和HCl,请写出反应的离子方程式:_______________。
(5)已知饮用水中的BO3- 对人类健康会产生危害,为了降低饮用水中BO3-的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将BO3-还原为B2,请配平化学方程式:
10Al+6NaBO3 + 4NaOH + 18H2O=□ ________ + 3B2↑。
若生成标况下的B2体积为5.6L,则反应过程中转移电子的物质的量为________。
在一个容积固定的反应器中,有一可左右滑动的密封隔板,两侧分别进行如图所示的可逆反应,各物质的起始加入量如下:A、B和C均为4.0 mol、D为6.5 mol、F为2.0 mol,设E为x mol,当x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器的正中位置,请填写以下空白。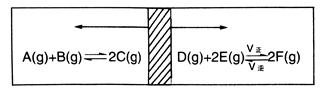
(1)若x=4.5,则右侧反应在起始时向__________(填“正反应”或“逆反应”)方向进行,要使起始反应维持向该方向进行,则x的取值范围__________。
(2)若x=4.5和5.0,则在这种情况下,当反应达平衡时,A的物质的量是否相等?__________(填“相等”、“不相等”或“不能确定”),其理由是__________________。
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度的升高,混合气体的颜色变深。
2NO2(g),随温度的升高,混合气体的颜色变深。
回答下列问题:
(1)反应的△H0(填“>”或“<”);
100℃时,体系中各物质浓度随时间变化如图所示。
在0~60s时段,反应速率v(N2O4)为mol•L-1•s-1;反应的平衡常数K1=mol/L。
(2)100℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020mol•L-1•s-1的平均速率降低,经10s又达到平衡。则:
① T100℃(填“>”或“<”)。
② 计算温度T时反应的平衡常数K2=mol/L。
(3) 温度T时反应达平衡后,将反应容器的容积减少一半,则平衡向(填“正”或“逆”)反应方向移动。
在2L密闭容器中,充入a molN2和b molH2,在一定温度下N2+3H2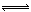 2NH3,达到平衡,容器中还剩余c molN2,则平衡时N2的转化率是,H2的转化率是,容器中H2的平衡浓度是mol/L,该温度下平衡常数的数值为。(用a、b、c表示出计算式即可)
2NH3,达到平衡,容器中还剩余c molN2,则平衡时N2的转化率是,H2的转化率是,容器中H2的平衡浓度是mol/L,该温度下平衡常数的数值为。(用a、b、c表示出计算式即可)