下表是元素周期表的短周期部分,表中字母分别表示一种元素,回答下列问题:
| a |
|
|
|||||
| |
|
|
c |
e |
f |
g |
|
| |
|
b |
d |
|
|
h |
|
(1)e、f、g三种元素气态氢化物的稳定性由弱到强的顺序为(用化学式表示)__________。
(2)元素e的气态氢化物电子式为__________,该氢化物与其最高价氧化物的水化物反应生成的物质所含化学键类型为___________,属于_______化合物(填离子或共价)。
(3)a、c两种元素可形成多种化合物,其中化合物A的产量是衡量一个国家石油化工发展水平的标志,则: A的结构简式为____________;以A为原料,可制得当今世界上产量最大的塑料产品,该反应类型为_________________;A可与H2O反应生成化合物B,该反应类型为__________________。B与CH3COOH反应生成有果香气味的产物,该反应的化学方程式为_____________________________________________________ ;该反应类型为_____________。B在以铜为催化剂时反应生成有刺激性气味的产物,该反应的化学方程式为_________________________________________________________。
海水是巨大的资源宝库。下图是人类从海水资源获取某些重要化工原料的流程示意图。
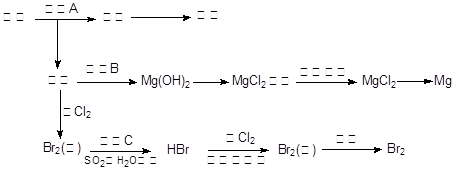
回答下列问题:
(1)操作A是_________________(填实验基本操作名称)。用何种方法知道海水晒盐的过程中溶液里食盐含量在逐渐提高?________
a.分析氯化钠含量b.测定溶液密度c.观察是否有沉淀析出
(2)操作B需加入下列试剂中的一种,最合适的是______(选填编号)。
a.氢氧化钠溶液 b.澄清石灰水 c.石灰乳d.碳酸钠溶液
(3)向苦卤中通入Cl2,发生反应的离子方程式是____________________________,操作C是_______________________________。
(4)上图中虚线框内流程的主要作用是_______________________;与之目的相同的流程在上图中还有几处,试指出其中一处________________________。
(5)将MgCl2转化为Mg时获得的副产品是_____________,用化学方程式表示该物质的某种用途______________________________________。
已知:氧化性:KMnO4>HNO3;Bi位于周期表中VA族,+3价较稳定,Bi2O3为碱性氧化物,Bi3+的溶液为无色。取一定量硝酸酸化的Mn(NO3)2溶液依次进行下列实验,现象记录如下:
① 向其中加入适量的NaBiO3,溶液变为紫红色。② 继续滴加适量H2O2,紫红色褪去,并有气泡产生。③ 再加入适量的PbO2固体,固体溶解,溶液又变为紫红色。
回答下列问题:
(1)写出实验①反应的离子方程式:______________________________________。
(2)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为____________________________。
(3)向反应③得到的溶液中通入SO2气体,看到的现象是____________________________。
(4)若实验②放出了336mL气体(标准状况),则反应①被氧化的Mn(NO3)2为________mol。
不同元素的原子在分子内吸引电子的能力大小可用一定数值x来表示, x越大,其原子吸引电子的能力越强。 下面是某些短周期元素的x值:
| 元素符号 |
Li |
Be |
B |
C |
O |
F |
Na |
Al |
Si |
P |
S |
Cl |
| x值 |
0.98 |
1.57 |
2.04 |
2.55 |
3.44 |
3.98 |
0.93 |
1.61 |
1.90 |
2.19 |
2.58 |
3.16 |
(1)通过分析x值变化规律,确定Mg的x值范围:_______ < x(Mg) <_________。
(2)推测x值与原子半径的关系是________________________________;根据短周期元素的x值变化特点,体现了元素性质的_________________变化规律。
(3)分别指出下列两种化合物中氧元素的化合价:HClO_________,HFO________。
(4)经验规律告诉我们:当成键的两原子相应元素x数值的差值(Δx),当Δx>1.7时,一般为离子键,当Δx<1.7时,一般为共价键,试推断AlBr3中化学键类型是________________。
(5)预测元素周期表中,x值最小的元素位于______周期________族(放射性元素除外)。
化合物M是可降解的聚酯,化合物E是有机合成中间体,一种合成路线如下图所示。
完成下列填空:
(1)写出反应类型。反应①:反应;反应②: 反应。
(2)写出结构简式。B; M。
(3)写出反应①的化学反应方程式。
(4)写出检验B完全转化为C的方法。
所用试剂的化学式; 实验现象 。
(5)有苯环和4种不同化学环境氢原子且与E互为同分异构体的酯有种,写出其中的一种同分异构体的结构简式。
煤化工可制得甲醇。以下是合成聚合物M的路线图。
己知:芳香族化合物苯环上的氢原子可被卤代烷中的烷基取代。如:
完成下列填空:
(1)对路线图中有关物质的说法错误的是(选填序号)。
a.从合成气中也可获得合成氨的原料H2 b.甲醇可发生取代、氧化、消去等反应
c.也可用石油分馏的方法获得丙烯 d.可用分馏的方法从煤焦油中获得A
(2)通常实验室可用甲醇和制备CH3Br。
(3)C生成D的反应条件是 ; 写出M的结构简式 。
(4)取1.08g A物质(式量108)与足量饱和溴水完全反应能生成3.45g白色沉淀,写出A的结构简式。