Ⅰ利用化学原理对工厂排放的废水、废渣等进行有效检测与合理处理。
(1)染料工业排放的废水中含有大量有毒的 ,可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体)。除去
,可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体)。除去 的离子方程式为_____________。
的离子方程式为_____________。
常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 |
 |
 |
 |
 |
 |
 |
| 开始沉淀时的pH |
1.9 |
7.0 |
— |
— |
4.7 |
— |
| 沉淀完全时的pH |
3.2 |
9.0 |
11.1 |
8 |
6.7 |
9(>9溶解) |
(2)印刷电路铜板腐蚀剂常用FeCl3。腐蚀铜板后的混合浊液中,若 、
、 和
和 的浓度均为
的浓度均为 ,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中
,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中 和
和 的实验步骤:①__________;②___________;③过滤。(提供的药品:C12、浓
的实验步骤:①__________;②___________;③过滤。(提供的药品:C12、浓 、NaOH溶液、CuO、Cu)。
、NaOH溶液、CuO、Cu)。
Ⅱ.下图表示某些化工生产的流程(部分反应条件和产物略去)
(1)反应Ⅰ需在500℃进行,其主要原因是_________________。
(2)G转化为H的过程中,需要不断补充空气,其原因是_________________。
(3)写出反应Ⅲ的化学方程式_________________。
(4)工业上,向析出K的母液中通氨气,加入细小食盐颗粒,冷却后可析出副产品。通入氨气的作用是_________________(填序号)。
a. 增大 的浓度,使J更多地析出
的浓度,使J更多地析出
b. 使K更多地析出
c. 使K转化为M,提高析出的J的纯度
(5)写出上述流程所涉及的化学工业的名称_________________。
利用物质之间的性质差异可提纯物质。
(1)除去Fe2O3中的Al2O3,反应的离子方程式是__________。
(2)除去FeCl3溶液中的CuCl2,选用的试剂是__________。
(3)除去粗盐水中Ca2+、Mg2+、 等杂质,选用的试剂是①盐酸②BaCl2③NaOH④Na2CO3
等杂质,选用的试剂是①盐酸②BaCl2③NaOH④Na2CO3
i.上述4种试剂的加入顺序是__________。
ii.加入盐酸的作用是(用离子方程式表示)__________。
钠、铝两种金属单质在生产、生活中有着广泛的应用。
(1)能与冷水发生剧烈反应的是__________,能说明该反应发生时放出热量的实验现象是__________。
(2)表面能自然形成氧化层保护内层金属不被空气氧化的是__________。
(3)__________制成的容器在常温下可用来盛装浓硝酸。
红热的铁与水蒸气可发生反应:3Fe+ ,其中铁被__________(填“氧化”或“还原”),H2O作__________(填“氧化”或“还原”)剂。在该反应中,若消耗了3 mol Fe,转移电子的物质的量是__________。
,其中铁被__________(填“氧化”或“还原”),H2O作__________(填“氧化”或“还原”)剂。在该反应中,若消耗了3 mol Fe,转移电子的物质的量是__________。
(1)有人研究证明:使用氯气作自来水消毒剂,氯气会与水中有机物反应,生成如CHCl3等物质,这些物质可能是潜在的致癌致畸物质。目前人们已研发多种饮用水的新型消毒剂。下列物质不能作自来水消毒剂的是(填序号)。
| A.明矾 | B.二氧化氯 | C.臭氧 | D.高铁酸钠(Na2FeO4) |
(2)高铁(VI)酸盐是新一代水处理剂。其制备方法有:次氯酸盐氧化法(湿法)和高温过氧化物氧化法(干法)等。湿法是在碱性溶液中用次氯酸盐氧化铁(III)盐,写出该法的离子方程式:。
(3)用高铁(VI)酸盐设计的高铁(VI)电池是一种新型可充电电池,电解质溶液为KOH溶液,放电时的总反应:3Zn+2K2FeO4+8H2O→3Zn(OH)2+2Fe(OH)3+4KOH
①写出正极发生的电极反应式:。
②用高铁(VI)电池作电源,以Fe作阳极,以Cu作阴极,对足量KOH溶液进行电解,当有0.1molK2FeO4反应时,在电解池中生成H2L(标准状况),同时生成Fe(OH)3=mol。
③下表列出了某厂排放的含锌废水中的含量及国家环保标准值的有关数据:
| 含锌废水水质 |
经处理后的水国家环保标准值 |
|
| Zn2+浓度/(mg·L-1) |
≤800 |
≤3.9 |
| pH |
1~5 |
6~9 |
经处理后的废水pH=8,此时废水中Zn2+的浓度为mg/L(常温下,Ksp[Zn(OH)2]=1.2×1017),(填“符合”或“不符合”)国家环保标准。
(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气和水,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是。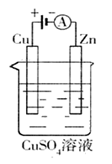
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。
肼—空气燃料电池放电时:
负极的电极反应式是;
正极的电极反应式是。
(3)下图是一个电化学过程示意图。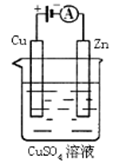
①锌片上发生的电极反应是。
②假设使用肼—空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼一空气燃料电池理论上消耗标准状况下的空气L(假设空气中氧气体积含量为20%)
(4)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反应的离子方程式是。