已知外电路中,电子由铜流向a极。有关下图所示的装置分析合理一项是( )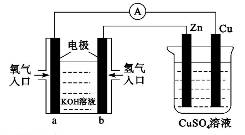
| A.该装置中Cu极为正极 |
| B.当铜极的质量变化为12.8 g时,a极上消耗的O2在标准状况下的体积为2.24 L |
C.b极反应的电极反应式为:H2一2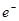 = 2H+ = 2H+ |
| D.一段时间后锌片质量减少 |
下列反应产生的气体,通过Na2SO3溶液不反应的是 ( )
①Na2O2和CO2②Al和NaOH溶液③MnO2和浓盐酸④浓硝酸和铜片⑤铜片和浓硫酸共热⑥固体NaCl和浓H2SO4⑦FeS和稀硝酸
| A.①② | B.② | C.①②⑤ | D.全部反应 |
美国“9·11”恐怖袭击事件给纽约带来了一场严重的环境灾难——石棉污染,易使吸人石棉纤维者患肺癌,已知石棉是硅酸盐矿物,某种石棉的化学式可表示为Ca2MgxSiyO22(OH)2,则x、y的值分别为 ( )
| A.8,3 | B.5,8 | C.3,8 | D.5,5 |
人们把食品分为“绿色食品”、“蓝色食品”、“白色食品”等,绿色植物通过光合作用转化的食品叫做“绿色食品”,海洋提供的食品叫做“蓝色食品”,通过微生物发酵制得的食品叫做“白色食品”。下列物质属于“白色食品”的是 ( )
| A.面粉 | B.食醋 | C.海带 | D.菜油 |
在密闭容器中发生反应a X(气)+b Y(气) c W(气)+d Z(气),若反应达到平衡后,保持温度不变,将气体压缩到原来的1/2体积,再次达到平衡时,Z的浓度是原平衡的1.8倍,下列叙述中正确的是
c W(气)+d Z(气),若反应达到平衡后,保持温度不变,将气体压缩到原来的1/2体积,再次达到平衡时,Z的浓度是原平衡的1.8倍,下列叙述中正确的是
| A.平衡向逆反应方向移动 | B.a+b>c+d |
| C.W的体积分数增大 | D.X的转化率降低 |
以下各种尾气吸收装置中,适合于吸收易溶性气体,而且能防止倒吸的是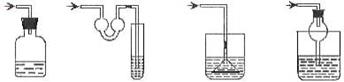
A B CD