过量的铁粉与100 mL 0.1 mol/L的稀盐酸反应,反应速率太快。为了降低此反应速率而不改变产生H2的量,可以使用如下方法中的( )
①加H2O ②加NaOH固体 ③滴入过量浓硫酸 ④加少量的CH3COONa固体 ⑤加NaCl溶液
⑥滴加几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发)⑧改用10 mL 1 mol/L的盐酸
| A.①⑥⑦ | B.①④⑤ | C.③⑦⑧ | D.③⑥⑦⑧ |
量取10mL碘的饱和水溶液,倒入分液漏斗中,然后再注入4mL四氯化碳,用力振荡后静置,实验现象为
| A.液体分层,上层为四氯化碳层,黄色 |
| B.液体分层,上层为水层,紫色 |
| C.液体分层,下层为四氯化碳层,紫色 |
| D.液体分层,下层为水层,黄色 |
下列离子方程式正确的是
A.铜片插入到硝酸银溶液中Cu +Ag+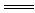 Cu2+ +Ag Cu2+ +Ag |
B.硫酸镁跟氢氧化钡反应Ba2++SO42-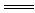 BaSO4↓ BaSO4↓ |
C.铁片插入盐酸中2Fe+6H+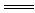 2Fe3++3H2↑ 2Fe3++3H2↑ |
D.氢氧化钠溶液和硫酸溶液反应H++OH-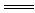 H2O H2O |
下列叙述正确的是
| A.蔗糖溶液不导电,因此蔗糖溶液是非电解质 |
| B.醋酸溶液的导电能力可能比稀硫酸强 |
| C.SO3溶于水,其水溶液能导电,SO3是电解质 |
| D.金刚石是单质,不导电,因此金刚石是非电解质 |
下列变化,需加入氧化剂才能实现的是
| A.CO→CO2 | B.MnO4-→Mn2+ |
| C.SO2→H2SO3 | D.NaCl→AgCl |
下列叙述正确的是
| A.1 mol H2O的质量为18g/mol |
| B.3.01×1023个SO2分子的质量为32g |
| C.CH4的摩尔质量为16g |
| D.标准状况下,1 mol任何物质体积均为22.4L |