近期曝出的“毒大米”事件,引起了国人的震惊和忧虑,又一次把环境问题摆在了我们面前。“毒大米”是由镉污染引起的,会对人体健康造成严重危害。镉元素在元素周期表中的图示如图所示。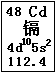
请回答下列问题:
(1)镉元素的原子序数为 ,在元素周期表中的位置是 。
(2)有人说:“‘毒大米’中镉的含量很低,每人每天食用大米量也较少,所以,不会对人体健康造成严重危害。”你对这种说法有何评论? 。
(3)你认为“毒大米”中镉的来源是什么? 。
(4)镉也是生产电池的重要材料,镉镍二次电池(碱性)的放电和充电反应为:
Cd + 2NiO(OH) + 2H2O Cd(OH)2+ 2Ni(OH)2
Cd(OH)2+ 2Ni(OH)2
电池的负极是 。
负极的电极反应式为 。
若负极消耗a g反应物,产生N个电子的电量,则阿伏加德罗常数NA= 。
(9分)为了科学饮食,了解一些与食品相关的化学知识是必要的。
(1)油炸虾条、薯片等容易挤碎的食品,不宜选用真空袋装,而应采用充气袋装。下列气体中不应该充入的是______。
A.氮气 B.二氧化碳
C.空气 D.氧气
(2)为使以面粉为原料的面包松软可口,通常用碳酸氢钠作发泡剂,因为它______。
①热稳定性差 ②增加甜味 ③产生二氧化碳 ④提供钠离子
A.②③ B.①③
C.①④ D.③④
(3)能直接鉴别氯化钠和葡萄糖两种未知浓度溶液的方法是______。
A.观察颜色 B.测量密度
C.加热灼烧 D.分别闻味
(9分)人体中胃酸的主要成分是盐酸。胃酸可帮助消化食物,但胃酸过多会使人感到不适,服用适量的小苏打(碳酸氢钠)可使症状明显减轻。
(1)写出小苏打和盐酸反应的离子方程式:_____________________________________________________;
(2)三硅酸镁(2MgO·3SiO2·nH2O)是治疗胃溃疡药物“胃舒平”的有效成分之一,具有抗酸作用,写出它与胃酸反应的化学方程式______________________;与“胃得乐”(主要成分为MgCO3)相比,它的优点是______________________。
(12分)有四种常见药物:①阿司匹林;②青霉素;③胃舒平;④麻黄碱。请回答下列问题(填序号)。
(1)由于具有兴奋作用,国际奥委会严禁运动员服用的药物是______;
(2)某同学胃酸过多,应选用的药物是______,
(3)从用药安全角度考虑,使用前要进行皮肤敏感性测试的药物是______;
(4)滥用药物会导致不良后果,如过量服用引起中毒,应立即停药,并静脉注射NaHCO3溶液的是______。
有pH=12的NaOH溶液100mL。如果将其pH降为11,那么:(忽略混合时溶液体积的变化)
(1)若用蒸馏水应加入______________mL
(2)若用pH=10的NaOH溶液应加入_____________mL
(3)若用pH=2的盐酸溶液应加入_____________mL
(4)若用0.01mol∙L-1的醋酸应加入的范围是________________。
( 10分)在密闭容器中进行下列反应:CO2(g)+C(s)  2CO(g) ΔH>0,起始通入2molCO,达到平衡后,改变下列条件,则指定物质的浓度、百分含量(填“不变”“增大”“减小”)及平衡如何变化(填“正移”“逆移”“不移动”):
2CO(g) ΔH>0,起始通入2molCO,达到平衡后,改变下列条件,则指定物质的浓度、百分含量(填“不变”“增大”“减小”)及平衡如何变化(填“正移”“逆移”“不移动”):
(1)增加C,平衡________,c(CO)________。
(2)减小密闭容器的体积,保持温度不变,则平衡______________,c(CO2)___ _____。
(3)通入N2,保持密闭容器的体积和温度不变,则平衡________,c(CO2)________。
(4)保持密闭容器的体积不变,升高温度,则平衡__________________,c(CO)________
(5)恒压通入N2,CO2的百分含量
(6)恒压再通入2molCO,CO2的百分含量