常温下,向l00 mL 0.01 mol/LHA溶液中逐滴加入0.02 mol/LMOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中,正确的是
| A.HA为一元强酸,MOH为一元强碱 |
| B.K点所示溶液中c(A-)>c(M+) |
| C.N点水的电离程度小于K点水的电离程度 |
| D.K点对应的溶液的pH=10,则有c(MOH)+c(OH-)-c(H+)=0.005mol/L |
下列图示与对应的叙述一定正确的是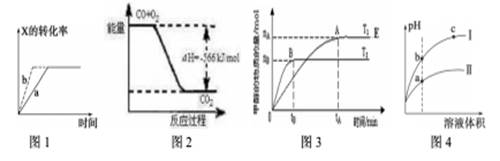
| A.图1所示,反应X(g)+2Y(g)3Z(g),b的压强一定比a大 |
| B.图2表示CO生成CO2的反应过程和能量关系 |
| C.图3表示反应CO+2H2CH3OH,其中温度T1>T2,在其他条件不变的情况下,将处于E点的体系的体积压缩到原来的1/2,平衡正向移动,氢气浓度增大 |
| D.图4所示,用水稀释pH相同的盐酸和醋酸,I表示盐酸,II表示醋酸,且溶液导电性c>b>a |
常温下a mol·L-1稀氨水和b mol·L-1稀盐酸等体积混合,对混合后溶液判断一定正确的是
| A.若a=b,则c(NH)=c(Cl-) |
| B.若a>b,则c(NH)>c(Cl-) |
| C.若a>b,则c(OH-)>c(H+) |
| D.若a<b,则c(OH-)<c(H+) |
I2在KI溶液中存在平衡:I2(aq)+I-(aq) I3-(aq),某I2、、KI混合溶液中, c(I3-)与温度T的平衡曲线图如下。下列说法不正确的是
I3-(aq),某I2、、KI混合溶液中, c(I3-)与温度T的平衡曲线图如下。下列说法不正确的是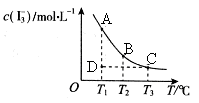
| A.反应I2(aq)+I-(aq)I3- (aq)的△H>0 |
| B.若温度为,反应的平衡常数分别为 |
| C.若反应进行到状态D时,一定有 |
| D.状态A与状态B相比,状态A的c(I2) 小 |
氯碱工业的产物NaOH与不同物质反应可以生成不同的盐。已知常温下,浓度均为0.1 mol/L的4种钠盐溶液pH如下表:
| 溶质 |
Na2CO3 |
NaHCO3 |
NaClO |
NaHSO3 |
| pH |
11.6 |
9.7 |
10.3 |
5.2 |
下列说法中正确的是
A.向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度
B.四种溶液中,水的电离程度最大的是NaClO
C.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最大的是H2SO3
D.NaHSO3溶液中离子浓度大小顺序为c(Na+)> c(H+)>c(HSO3-) >c(SO32-)>c(OH-)