A、B分别为第三周期和第四周期的同一主族不同元素的原子,它们原子核内的质子数都等于中子数①若A为IIA族,其质量数为x,则B的质子数为y ②若A为ⅣA族,其质子数为m,则B的质量数为n,在下列各组值中,y和n的值分别是
A.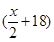 和
和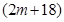
B.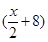 和
和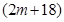
C.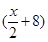 和
和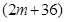
D.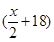 和
和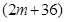
常温下,对下列各溶液的叙述不正确的是()
A.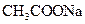 溶液中: 溶液中: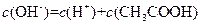  |
B.在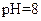 的 的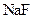 溶液中, 溶液中,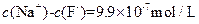 |
C.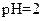 的盐酸与 的盐酸与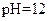 的 的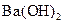 溶液等体积混合后,溶液中一定有 溶液等体积混合后,溶液中一定有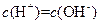 |
D.向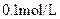 氨水中加入少量 氨水中加入少量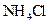 固体,溶液中 固体,溶液中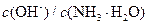 增大 增大 |
以Pt为电极,电解含有金属离子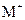 、
、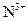 各
各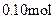 的溶液,阴极析出的金属单质或气体的总物质的量(y)与导线中通过电子的物质的量(x)的关系如图所示。对离子氧化能力的强弱判断正确的是(选项中
的溶液,阴极析出的金属单质或气体的总物质的量(y)与导线中通过电子的物质的量(x)的关系如图所示。对离子氧化能力的强弱判断正确的是(选项中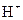 为氢离子)()
为氢离子)()
A.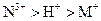 |
B.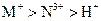 |
C.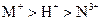 |
D.条件不足,无法确定 |
下列叙述中,不正确的是()
①熔点:金刚石>晶体硅>单质硫
②气态氢化物稳定性:H2O>HF>H2S
③同一主族的元素的氢化物,相对分子质量越大,它的沸点一定越高
④因为常温下白磷可自燃,而氮气须在放电时才与氧气反应,所以非金属性:P>N
⑤ⅥA、ⅦA族元素的阴离子与同周期稀有气体元素的原子具有相同的核外电子排布
A.①②③ B.②③④ C.②④⑤ D.①③⑤
在自然界中的矿物中,CuSO4可将FeS2氧化,生成Cu2S、SO42-和Fe2+。下列表示该反应的离子方程式中,正确的是()
| A.14Cu2++5S22-+12H2O=7Cu2S+3SO42-+24H+ |
| B.14Cu2++5FeS2+28OH-=7Cu2S+3SO42-+5Fe2++14H2O |
| C.14Cu2+ +5FeS2+24OH-=7Cu2S+3SO42-+5Fe2++12H2O |
D.14Cu2++5Fe S2+12H2O=7Cu2S+3SO42-+5Fe2++24H+ S2+12H2O=7Cu2S+3SO42-+5Fe2++24H+ |
下列各元素中,一定属于主族元素的是()
| A.X元素能形成+7价的含氧酸及其盐 |
| B.Y元素原子最外层电子数为2 |
| C.Z元素的阴离子与同一周期稀有气体元素的原子电子层结构相同 |
| D.R元素的最高价氧化物是酸性氧化物 |