有机物A常用于食品行业。已知9.0gA在足量O2中充分燃烧,混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,经检验剩余气体为O2。
(1)A分子的质谱图如下图所示,从图中可知其相对分子质量是90,则A的分子式是______________。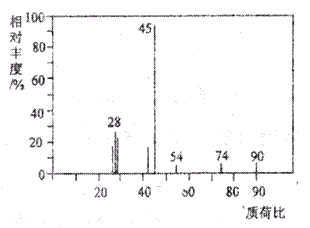

(2)A能与NaHCO3溶液发生反应,A一定含有的官能团名称是_____________。
(3)A分子的核磁共振氢谱有4个锋,峰面积之比是1:1:1:3,则A的结构简式是_______________。
(4)0.1mol A与足量Na反应,在标准状况下产生H2的体积是__________________L。
(5)A在一定条件下可聚合得到一种聚酯,用于制造手术缝合线,其反应的化学方程式是___________________。
从樟科植物枝叶提取的精油中其中含有下列甲、乙两种成分:
(1)甲中含氧官能团的名称为________________________。
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同);其中反应Ⅰ的反应类型为_________________,反应Ⅱ(Y→乙)的化学方程式为____________(注明反应条件)。
某有机物A,由C、H、O三种元素组成,在一定条件下,由A可以转化为有机物B、C、D和E;C又可以转化为B、A。它们的转化关系如下:
已知D的蒸气密度是氢气的22倍,并可以发生银镜反应
(1)写出下列物质的结构简式。B___________________D_________________
(2)完成下列阶段变化的化学方程式。③__________⑦_____________⑧__________
只需用一种试剂即可将酒精、苯酚溶液、四氯化碳、环己烯、甲苯五种无色液体区分开来,该试剂是____________(填序号)①FeCl3溶液②溴水③KMnO4溶液④金属钠其中所能发生化学反应的方程式为______________________。
利用以下实验装置完成比较乙酸、碳酸和苯酚的羟基中氢原子的活泼性实验。
(1)利用上述仪器组装实验装置,其中A管接________(填字母,下同)口,B管接________口,C管接________________中。
(2)丙同学查资料发现乙酸有挥发性,于是在试管F之前增加了一个盛有_________溶液的洗气装置,使乙同学的实验设计更加完善。
(3)完成装置中反应方程式(Ⅰ)__________________(Ⅱ)_____________;(Ⅲ)中实验现象________________________。