有几种元素的微粒的核外电子层结构如图所示。
请回答下列问题。
(1)若该微粒是中性微粒,这种微粒的符号是_____________。
(2)若该微粒的盐溶液能使溴水退色,并出现浑浊,这种微粒的符号是____________。
(3)若该微粒的氧化性很弱,得到1个电子后变为原子,其单质的还原性很强,这种微粒的符号是________________。
(4)若该微粒的还原性很弱,失去1个电子后变为原子,其单质的氧化性很强,这种微粒的符号是_______________
以下三例是常见的化学实验:
①CO2通入澄清的石灰水,溶液先浑浊后澄清;
②将稀盐酸逐滴滴入Na2CO3溶液,开始时无现象,后产生气体;
③将NaOH溶液逐滴滴入AlCl3溶液,先产生白色沉淀,后沉淀消失;
回答下列问题:
(1)每例中均可用前后两个化学方程式来说明变化的规律,试用简要文字,说明这两个反应间的关系:
(2)每例中若要保证后一个反应发生,必须具备的条件是什么?
。
(3)将各例中前后两个反应方程式叠加,写出一个总的方程式。
。
硫酸亚铁是一种可用于治疗缺铁性贫血的药剂,而硫酸铁则无这种药效。当用硫酸亚铁制成药片时外表包有一层特殊的糖衣,这层糖衣的作用是。如果药片已经失效,应如何检验?写出主要步骤和现象。
三硅酸镁被用来治疗胃溃疡是因为该物质不溶于水,服用后中和胃酸作用持久。把三硅酸镁Mg2Si3O8·nH2O改写成氧化物形式为:_____ ____,
写出和胃酸反应的化学方程式: __。
材料在人类生活、生产中发挥着重要的作用。
(1)钠、铝、铁是常见的金属。
①在三种金属元素中,所形成氧化物种类最多的是;三种元素形成的氧化物中属于碱性氧化物的有种。
②向盛有硫酸铝溶液的试管中滴加氨水,反应的离子方程式为,
得到的胶状沉淀物在医疗上治疗胃酸过多,利用的原理用离子方程式表示为。
③向盛有氯化铁、氯化亚铁、氯化铜混合溶液的烧杯中加入铁粉和铜粉,反应结束后,剩余固体中有铜无铁,则溶液中一定存在的阳离子为,可能存在的阳离子为,一定不存在的阳离子为。
④生产中曾用铝热反应(铝与铁的氧化物反应生成氧化铝和铁)焊接钢轨,则铝与氧化铁发生反应的化学方程式为 ,要得到1mol金属铁,需要铝的质量 g。
(2)工业上,在电炉中用炭粉还原二氧化硅可制得硅和一氧化碳。若向电炉里加入适量炭粉和30g二氧化硅,通电后反应,生成的一氧化碳在标况下的体积为。
用如下图所示装置可以完成一系列实验(图中夹持装置已略去)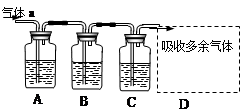
请回答下列问题:
Ⅰ.若气体a是Cl2,装置A、B、C中的试剂依次为: FeCl2溶液、淀粉KI溶液、石蕊溶液。
| 装置 |
A |
B |
C |
D |
| 试剂 |
FeCl2溶液 |
淀粉KI溶液 |
石蕊溶液 |
|
| 现象 |
溶液由浅绿色变为棕黄色 |
|||
| 离子方程式 |
II.若气体a是SO2,装置A、B、C中的试剂依次为:品红溶液、酸性高锰酸钾溶液、氢硫酸(硫化氢的水溶液)。
| 装置 |
A |
B |
C |
| 试剂 |
品红溶液 |
酸性高锰酸钾溶液 |
硫化氢的水溶液 |
| 现象 |
紫色退去 |
||
| 体现SO2的性质 |
氧化性 |
(1)写出C中发生反应的化学方程式。
(2)D装置中用氢氧化钠溶液来吸收SO2,为了防止倒吸,应该选用下列装置中的(填序号)。