某温度下,浓度都为1 mol·L-1的两种气体X2和Y2在密闭容器中反应生成气体Z,经过一段时间后c(X2)为0.4 mol·L-1, c (Y2)为0.8 mol·L-1, c (Z)为0.4 mol·L-1,则反应为( )
A.X2+2Y2 2XY2 2XY2 |
B.2X2+Y2 2X2Y 2X2Y |
C.3X2+Y2 2X3Y 2X3Y |
D.X2+3Y2 2XY3 2XY3 |
将氨水缓缓地滴入盐酸中至中性,下列有关的说法:①盐酸过量②氨水过量③恰好完全反应④c (NH4+) = c(Cl-)⑤c (NH4+) < c(Cl-) 正确的是
| A.①⑤ | B.③④ | C.②⑤ | D.②④ |
用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加快的是
| A.加热 | B.改用硝酸 |
| C.滴加少量CuCl2溶液 | D.不用铁片,改用铁粉 |
以石墨棒作电极,电解氯化铜溶液,若电解时转移的电子数是3.01×1023,则此时在阴极上析出铜的质量是
A .8g
.8g  B.16g C.32g D.64g
B.16g C.32g D.64g
在某一密闭窗口中,充入一定量的HI气体,发生反应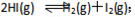 ,
, ,在t1时刻时达到平衡,t2时加热升温并保持,到t3时刻时又达到新的平衡,符合这一变化的图像是:
,在t1时刻时达到平衡,t2时加热升温并保持,到t3时刻时又达到新的平衡,符合这一变化的图像是:
一种新型的利用电化学反应原理来制备硫酸的方法已经问世,其装置如图所示,电极为多孔的惰性电极,稀硫酸作电解质溶液,电池工作时,一极通入SO2气体,另一极通入O2。下列有关叙述正确的是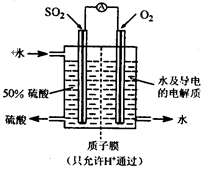
| A.通入O2的电极为负极 |
| B.正极反应式为:O2+4e-+2H2O=4OH- |
| C.电池工作时H+移向负极 |
| D.负极反应式为:2SO2 - 4e- + 4H2O = 2SO42- + 8H+ |