化合物M是一种治疗心脏病药物的中间体,以A为原料的工业合成路线如下图所示。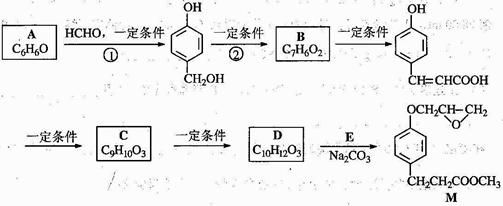
已知:RONa+ R’X→ROR’+ NaX
根据题意完成下列填空:
(1)写出反应类型。反应① 反应②
(2)写出结构简式。A C
(3)写出 的邻位异构体分子内脱水产物香豆素的结构简式 。
的邻位异构体分子内脱水产物香豆素的结构简式 。
(4)由C生成D的另一个反应物是 ,反应条件是 。
(5)写出由D生成M的化学反应方程式 。
(6)A也是制备环己醇(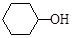 )的原料,写出检验A已完全转化为环己醇的方法。
)的原料,写出检验A已完全转化为环己醇的方法。
_______________________________________________________________________。
下表为元素周期表的一部分,请回答有关问题:
| ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0A |
|
| 2 |
① |
② |
||||||
| 3 |
③ |
④ |
⑤ |
⑥ |
⑦] |
⑧ |
||
| 4 |
⑨ |
⑩ |
(1)⑤和⑧的元素符号是__▲__和__▲__ ;
(2)表中最活泼的金属是__▲_ ,非金属性最强的元素是_▲__(填写元素符号);
(3)表中能形成两性氢氧化物的元素是__▲_ ,分别写出该元素的氢氧化物与⑥最高价氧化物对应水化物反应的化学方程式: ___________▲____________ ,
(4)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱:_______ __▲_________ 。
__▲_________ 。
(5)0.1 mol的单质⑦与50 mL 1.5 mol/L的FeBr2溶液反应,则被氧化的Fe2+和Br-的物质的量之比是: __▲__。
根据周期表对角线规则,金属Be与Al单质及其化合物性质相似。试回答下列问题:
(1)写出Be与NaOH溶液反应生成Na2BeO2的离子方程式▲;
(2)Be(OH)2与Mg(OH)2可用__▲___试剂鉴别,其反应离子方程式为▲。
(3)Li和Mg根据对角线规则,性质也相似,则Li在空气中燃烧,主要产物的化学式是__▲____;同时还有少量▲生成。
有A、B、C、D四种元素,A元素是地壳中含量最多的金属元素;B元素的原子其M层电子数比L层少1个电子;C元素的原子得到2个电子、D元素的原子失去1个电子所得到的微粒都具有与氖原子相同的电子层结构。回答下列问题:
(1)上述四种元素中C的名称是______▲__________;
(2)画出B元素原子的结构示意图________▲________ ;
(3)写出下列化学方程式:
单质D在单质C中燃烧的化学方程式______▲______ ____ ;
____ ;
A的氢氧化物和D的氢氧化物反应的离子方程式_________▲_______ 。
分子筛可用于物质的分离提纯。某种型号的分子筛的工业生产流程可简单表示如下: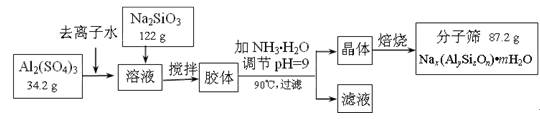
|
 成。已知常温下,Al(OH)3浊液的pH=3,其Ksp=1×10-36,则其中c(Al3+)= ▲ 。
成。已知常温下,Al(OH)3浊液的pH=3,其Ksp=1×10-36,则其中c(Al3+)= ▲ 。
 ▲ (写化学式)。
▲ (写化学式)。
 分子筛。
分子筛。
(12分)
雷尼镍(Raney-Ni)是一种历史悠久、应用广泛的催化剂,由镍-铝合金为原料制得。
(1)元素第一电离能:Al ▲Mg(选填:“>”、“<”、“=”)
(2)雷尼镍催化的一实例为: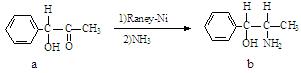
化合物b中进行sp3杂化的原子有: ▲。
(3)一种铝镍合金的结构如下图,与其结构相似的化合物是: ▲(选填序号)。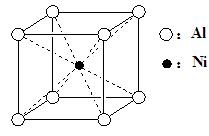
a.氯化钠b.氯化铯c.石英d.金刚石
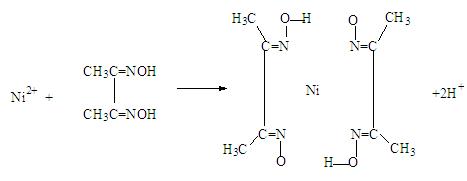
(4)实验室检验Ni2+可用丁二酮肟与之作用生成腥红色配合物沉淀。
①Ni2+在基态时,核外电子排布式为: ▲。
②在配合物中用 化学键和氢键标出未画出的作用力(镍的配位数为4)。
化学键和氢键标出未画出的作用力(镍的配位数为4)。