下图为氯化钠、碳酸钠在水中的溶解度曲线,请回答下列问题

(1)碳酸钠和氯化钠混合溶液的
7(填"
"或"
"或"
").
(2)
时,碳酸钠的溶解度为
.
(3)大于
时,碳酸钠的溶解度氯化钠的溶解度(填"
"或"
"或"
").
(4)
时,碳酸钠和氯化钠均饱和溶液,当温度降低到
时,析出的主要物质是(填化学式).
(5)为检验(4)中析出的物质,取少量样品于试管中加入足量的(填化学式)溶液,完全溶液,并有气体产生,再加入几滴稀(填化学式)溶液,有白色沉淀产生.
微观示意图可形象地表示微粒发生的变化。
(1)请在如图第二、三个方框中。把NH3在纯氧中燃烧(4NH3+3O2 2N2+6H2O)的微观粒子补充完整:
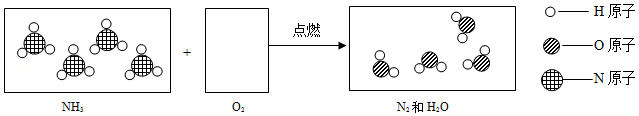
(2)第三个方框中的物质属于 (填:“单质”、“化合物”、“纯净物”、”混合物”)。
解释生活中的现象:
(1)活性炭净水原理是 。
(2)用水灭火原理 。
(3)如果用硬水和肥皂洗衣服,会出现 ,洗不干净衣服。
(4)如果用铁桶装农药“波尔多液”(硫酸铜溶液+石灰浆),铁桶受到腐蚀的化学反应方程式为 。
菱锰矿(含有MnCO3)常用稀H2SO4来浸出Mn2+:
(1)浸出Mn2+发生的是复分解反应,该化学方程式是 。
(2)为探究浸锰的最佳工艺条件,某研究小组首先进行了单因素实验,数据如下:
|
矿酸比 |
1:0.4 |
1:0.5 |
1:0.6 |
1:0.7 |
1:0.8 |
|
浸出率/(%) |
75.9 |
83.8 |
91.8 |
92.8 |
93.0 |
①矿酸比从1:0.4到1:0.8的过程中,稀H2SO4的用量 (填“增大”或“减小”)
②分析数据得知:当矿酸比从1:0.4到1:0.6时,Mn2+浸出率 ;
当矿酸比从1:0.6到1:0.8时,Mn2+浸出率 ;
(3)该研究小组选定两个因素作为研究条件进行对比实验,数据如下:
|
矿酸比 |
温度/(℃) |
浸出率/(%) |
|
|
1 |
1:0.5 |
60 |
80.2 |
|
2 |
1:0.5 |
80 |
83.8 |
|
3 |
1:0.6 |
60 |
X |
|
4 |
1:0.6 |
80 |
91.8 |
①表中X最有可能的数值为 。
A.79.7 B.80.8 C.87.6 D.92.8
②该工艺的最佳条件为:矿酸比: ;温度: 。
氯化亚铜(CuCl)广泛应用于冶金、电镀、医药等行业。已知CuCl难溶于水和乙醇,在潮湿空气中易变质。CuCl的制备流程如下:

(1)“滤液1”中除了Na+、SO42﹣外,还存在较多的离子是 、 (写离子符号)
(2)“反应”中发生的化学变化是2CuCl2+Na2SO3=2CuCl↓+2NaCl+SO3,产生的SO3迅速与水化合生成一种酸,该反应的化学方程式为 。
(3)“操作a”的名称是 。本流程中可以循环利用的物质(水除外)是 。(写化学式)
(4)可用“水洗”的原因是 ,“醇洗”的目的是 。
(5)160g CuSO4与足量NaCl经上述制备流程,可生成的CuCl最多是 g。
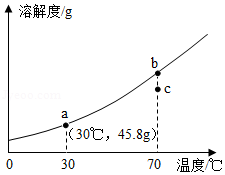
如图为KNO3的溶解度曲线,a、b在溶解度曲线上。
(1)a点对应的溶液是 溶液。(填“饱和”或者“不饱和”)。
(2)a点对应的溶液的质量分数是 。(只列计算式)
(3)将a点对应的溶液升温到70℃,其质量分数 。(填写“变大”、“变小”或“不变”)
(4)欲使KNO3溶液的状态从b点转化为c点,可采取的措施是 。