我国大部分地区深受酸雨的危害,煤燃烧产生的
是形成酸雨的主要污染物,
与水结合生成弱酸性亚硫酸
.
已知:
易分解生成水和
,也易与空气中的氧气或稀硝酸反应生成
;
和
都能使红色的品红溶液褪色.
(1)酸雨是
小于
(2)常用脱硫方法减少废气中的
,以生石灰
为脱硫剂,高温下与废气中的
与
化合生成
,化学方程式为
(3)实验室常用亚硫酸盐与
或
反应制备
,
与盐酸反应的化学方程式
(4)小鸿同学利用中和反应的原理,在空气中放置一段时间的酸雨(
约为3)中加入足量的
,并就反应后混合溶液的中盐成分进行如何探究:
【提出猜想】反应后的混合溶液中盐的成份是什么?
【进行猜想】猜想1:只有
猜想2:
猜想3:既有
,也有
【实验探究】限选试剂:稀硫酸、稀盐酸、稀硝酸、氯化钡溶液、澄清石灰水、品红溶液、紫色石蕊溶液
| 步骤 |
实验操作 |
预期现象与结论 |
| 1 |
各取
反应后的混合溶液分别加入
两只试管 |
|
| 2 |
向
试管中滴加足量的稀硫酸,随即滴入几滴红色品红溶液 |
证明含有 |
| 3 |
向
试管中,加入 |
先有白色沉淀,后有气体产生,沉淀部分溶解,证明含有
,则猜想3成立 |
以下是我们日常生活中常用各种清洗剂,选择适当的用品可以得到更好的清洗效果.
| 名称 |
洗涤灵 |
洁厕灵 |
炉具清洁剂 |
污渍爆炸盐 |
漂白粉 |
| 产品样式 |
 |
 |
 |
 |
 |
| 有效成分 或功能 |
清洗油污 |
盐酸 |
氢氧化钠 |
过碳酸钠 |
消毒 |
(2)以下物质可以使用洁厕灵清洗的是填字母序号).
a.铁锈 b.油渍 c.水垢(主要成分为碳酸钙和氢氧化镁)
(3)取上述一定量的炉具清洁剂,滴加几滴酚酞溶液,溶液变色,若将洁厕灵与炉具清洁剂混合,可以发生右图所示的化学反应.图中a微粒的化学式为.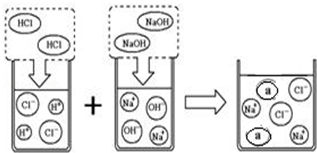
(4)"污渍爆炸盐"溶于水后会生成
和
.将爆炸盐溶于水后,再加入足量的洁厕灵,发生的化学反应方程式为.
(5)化学小组发现一袋包装破损的漂白粉,同学们对漂白粉其漂白作用是否失效产生了疑问.(当有效成分完全消失时,则漂白粉就完全失效;部分消失时,则为部分失效).
I.查阅资料:
①漂白粉的主要成分是
、
和
,其有效成分是
.
②
可溶于水,漂白原理是:它在空气中发生反应:
,
③
不稳定,易分解生成
和一种常见的单质气体.
④
的水溶液呈中性,
的水溶液呈酸性.
⑤
能可使有色物质(如:品红溶液)褪色.
II.交流讨论:
该小组同学经过分析得出
分解时除生成
外,生成的另一种常见气体是 .
III.实验探究:下表是探究某漂白粉是否完全失效的实验,请根据表中结论,进行填空.
| 实验步骤 |
实验现象 |
实验结论 |
| 把少量漂白粉样品加入水中,通入足量的
气体, _ . |
. |
漂白粉的漂白作用已完全失效. |
猜想一
和
;猜想二: ;
小明同学认为猜想中的成分
,除漂白粉的有效成分在空气中发生反应生成外,还有其它来源,请你用化学方程式表示 .
小聪同学进行实验证明失效后的漂白粉的成分符合猜想一,而与猜想二不符.小聪同学的实验方案是: .
某学习小组的同学在做碳酸钠溶液和澄清石灰水反应的实验后,将反应后的浑浊液进行过滤,得到澄清的滤液,对于滤液的组成同学们做出如下猜想:
【猜想与假设】大家一致认为滤液中一定有氢氧化钠,生成氢氧化钠的化学方程式是;小明猜想还可能有氢氧化钙,小丽猜想还可能有氢氧化钙和碳酸钠,你还能做出的猜想是.
【活动与探究】请你设计一个实验方案验证你的猜想.
| 实验步骤 |
实验现象 |
实验结论 |
(1);
(2).
在学完"二氧化碳性质的探究"后,小明同学觉得按照课本实验(图①)不能完全说明是什么物质使紫色石蕊溶液变红色,他和小娜同学进行了如下实验探究: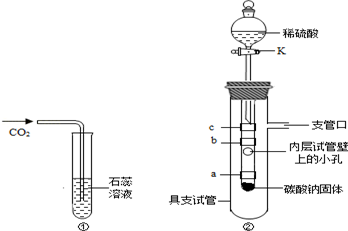
【猜想与假设】
猜想一:水使紫色石蕊溶液变红
猜想二:二氧化碳使紫色石蕊溶液变红
猜想三:二氧化碳与水反应生成的新物质使紫色石蕊溶液变红
【查阅资料与实验准备】
(1)将纸条浸泡在紫色石蕊溶液中,晾干后可制得紫色石蕊试纸.
(2)自制的紫色石蕊试纸遇酸变红色,遇碱溶液变蓝色.
【设计与实验】
小明同学设立了实验装置如图②.
图中
紫色石蕊试纸,缠绕在小试管上.
(1)猜想不正确.
(2)打开活塞
,滴入稀硫酸,观察并解释实验现象:
①试纸
没有明显变化,得出结论:猜想不正确.
②试纸
由紫色变为红色,得出结论:(用化学方程式表示)猜想正确.
③试纸首先变色,其原因是.
【交流与反思】
小娜同学认为,上图装置还可以同时验证:①二氧化碳能使澄清石灰水变浑浊;②二氧化碳不能燃烧不支持燃烧.
为了完成小娜同学的两个验证实验,请你对上面的实验装置进行简单的改进:.
为了探究溶质在水中溶解速率的影响因素,某学习小组设计了如下实验:
下列说法中正确的是()
| A. | 对比实验①和②,可探究水的温度对溶质在水中溶解速率的影响. |
| B. | 对比实验②和③,可探究水的温度对溶质在水中溶解速率的影响. |
| C. | 对比实验②和③,可探究固体溶质的形态对溶质在水中溶解速率的影响. |
| D. | 对比实验①和③,可探究固体溶质的形态对溶质在水中溶解速率的影响. |
某化学学习小组为比较镁和铝的金属活动性强弱设计了如下实验方案。
实验准备:
(1)用98%的浓硫酸配制l0%的硫酸溶液.现有烧杯、玻璃棒、胶头滴管,还需要的仪器有;在稀释时,一定要,并不断搅拌.
(2)准备两块表面积相同的镁条和铝条,并除去表面的氧化膜.要求两种金属片表面积相同的原因是.
【方案一】将除去氧化膜的镁条、铝条,分别与相同体积相同质量分数的硫酸反应,观察到镁比铝反应更剧烈,说明.
【方案二】
(1)连接仪器组装成如右图所示实验装置.某学生用抽拉法检查该装置的气密性,发现被拉出的针筒活塞一段时间后又回到原来的位置,你认为该装置是否漏气?.
(2)依次进行镁、铝与硫酸反应,写出镁与硫酸反应的化学方程式:;要比较两种金属活动性强弱,可以测定两种金属与硫酸反应得到相同体积氢气所需要的时间;还可测定.
【方案三】请设计一个与上述实验不同的方案,比较镁和铝的金属活动性强弱:.
