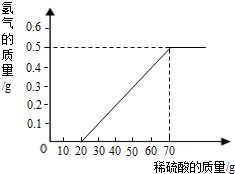
某兴趣小组用
镁条与溶质质量分数为
的稀硫酸反应.测得产生氢气的质量与稀硫酸的质量关系如图(假设镁条中除表面含有氧化镁外,没有其它杂质).
(1)当稀硫酸的质量为
,产生的氢气的质量为
(2)用化学方程式说明当稀硫酸的质量为
时,为什么不产生氢气
(3)计算镁条中镁元素的质量分数(写出计算过程).
小明在老师的指导下粗略测量一瓶稀盐酸的溶质质量分数,具体步骤如下:
步骤一:配制溶质质量分数约为1%的氢氧化钠溶液。
步骤二:向10克待测稀盐酸中逐滴滴入上述氢氧化钠溶液,并使
用pH计记录溶液的pH变化情况,绘制图像如图。
(1)在“步骤一”中有计算、、溶解三个具体步骤。
(2)在往稀盐酸中逐渐滴入氢氧化钠溶液的过程中,在a点的溶液中
的微粒有。(用化学符号表示)
(3)请结合右图,计算①该稀盐酸的溶质质量分数;②b点时溶液中溶质的质量分数。(结果精确到0.1%)(写出计算过程)
在盛有40g溶质质量分数为20%氢氧化钠溶液的烧杯中,用滴管吸取盐酸逐滴加入盛有氢氧化钠溶液的烧杯中,验证“中和反应会放热”,同时用pH计记录溶液pH的变化,绘制成以下函数图像。
⑴ 用玻璃棒蘸取X点溶液,在酒精灯火焰上加热至蒸干,玻璃棒上留下的固体中一定含有。(填化学式)
⑵ 为什么不能用氢氧化钠固体和稀盐酸反应验证“中和反应会放热”。
。
⑶ 当pH=7时,求溶液中溶质的质量分数。
“过碳酸钠”(2Na2CO3·3H2O2)俗称固体双氧水,它既有碳酸盐的性质,又有双氧水的不稳定性和氧化性,是很好的消毒剂和供氧剂,广泛应用于洗涤、印染和医药等领域。“过碳酸钠”的制备流程如下: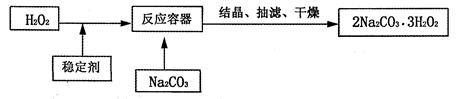
请回答下列问题:
(1)H2O2在催化或受热条件下易分解,说明化学变化的速度和相关;
(2)在“过碳酸钠”中加入下列物质时,不会导致“过碳酸钠”变质的是(填序号)。
| A.二氧化锰 | B.稀盐酸 | C.硫酸钠 | D.石灰水 |
(3)“过碳酸钠”极易分解,得到碳酸钠、水和氧气,其反应方程式可表示为
2(2Na2CO3.3H2O2)==4Na2CO3+6H2O+3O2↑
请通过计算说明(必须有计算的过程):
①若“过碳酸钠”分解产生氧气12g,则同时产生碳酸钠的质量是多少?
②若将上述产生的碳酸钠全部配制成溶质质量分数为10.6%的溶液,共需水多少毫升?
(4分)某校化学兴趣小组的同学为了制取氢氧化镁,他们取9.5g氯化镁固体全部溶解在40.5g水中制成不饱和溶液,然后向其中加入55.8g某溶质质量分数的氢氧化钠溶液恰好完全反应。请计算:
(1)制得的氢氧化镁的质量。
(2)反应后所得溶液中溶质的质量分数。
(1分)翡翠可以制成精美的饰品,其主要成分的化学式为NaAlSi2O6,请计算:
(1)NaAlSi2O6的相对分子质量为。
(2)NaAlSi2O6中硅元素和氧元素的质量比为(填最简整数比)。